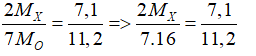100 câu trắc nghiệm Nhóm Halogen nâng cao phần 2 (có đáp án)
-
2073 lượt thi
-
25 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Cho các chất sau: KOH (1), Zn (2), Ag (3), Al(OH)3 (4), KMnO4 (5), K2SO4 (6). Axit HCl tác dụng được với các chất
 Xem đáp án
Xem đáp án
Đáp án A
HCl không phản ứng được với Ag (3) và (6).
Câu 2:
Cho các chất sau : CuO (1), Zn (2), Ag (3), Al(OH)3 (4), KMnO4 (5), PbS (6), MgCO3 (7), AgNO3 (8), MnO2 (9), FeS (10). Axit HCl không tác dụng được với các chất
 Xem đáp án
Xem đáp án
Đáp án D
Ag đứng sau (H) trong dãy hoạt động hóa học nên không phản ứng với HCl
PbS là kết tủa không tan trong axit
Câu 3:
Cho các phản ứng :
(1) O3 + dung dịch KI →
(2) F2 + H2O
(3) MnO2 + HCl đặc
(4) Cl2 + dung dịch H2S →
Các phản ứng tạo ra đơn chất là :
 Xem đáp án
Xem đáp án
Đáp án A
O3 + 2KI +H2O → O2 + 2KOH + I2
2F2 + 2H2O→ O2 +4 HF
MnO2 + 4HCl →MnCl2 + Cl2 + 2H2O
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
Câu 4:
Biết oxit cao nhất của nguyên tố X thuộc nhóm VIIA, có tỉ lệ khối lượng giữa các nguyên tố là mX : mO = 7,1 : 11,2. X là nguyên tố nào sau đây ?
 Xem đáp án
Xem đáp án
Đáp án A
Oxit cao nhất của X có dạng: X2O7
mX : mO = 7,1 : 11,2
⇒MX = 35,5(Cl)
Câu 5:
Hai miếng sắt có khối lượng bằng nhau và bằng 2,8 gam. Một miếng cho tác dụng với Cl2, một miếng cho tác dụng với dung dịch HCl. Tổng khối lượng muối clorua thu được là :
 Xem đáp án
Xem đáp án
Đáp án A
nFe = 0,05 (mol)
Fe + 2HCl → FeCl2 + H2
0,05 → 0,05
2Fe +3Cl2 → 2FeCl3
0,05 0,05
mMuối = 6,35 + 8,125 = 14,475 (g)
Câu 6:
Cho 69,6 gam MnO2 tác dụng với HCl đặc, dư. Dẫn toàn bộ lượng khí sinh ra vào 500 ml dung dịch NaOH 4M thu được dung dịch A. Coi thể tích của dung dịch thay đổi không đáng kể sau phản ứng. Nồng độ mol/l của các muối có trong dung dịch A là
 Xem đáp án
Xem đáp án
Đáp án B
(1)
Câu 8:
Sục khí clo vào dung dịch chứa NaBr và NaI đến phản ứng hoàn toàn thì thu được 1,17 gam NaCl. Số mol hỗn hợp NaBr và NaI có trong dung dịch đầu là :
 Xem đáp án
Xem đáp án
Đáp án A
Đặt: nNaBr = a(mol), nNaI = b(mol)
Ta có các phản ứng
2NaBr + Cl2→ 2NaCl + Br2(1)
a → a
2NaI + Cl2→ 2NaCl + I2(2)
b → b
Từ (1) và (2) nNaCl = = 0,02 (mol)
nNaBr + nNaI= a+b = 0,02 (mol)
Câu 9:
Hoà tan hoàn toàn 104,25 gam hỗn hợp X gồm NaCl và NaI vào nước được dung dịch A. Sục khí clo dư vào dung dịch A. Kết thúc thí nghiệm, cô cạn dung dịch, thu được 58,5 gam muối khan. Khối lượng NaCl có trong hỗn hợp X là :
 Xem đáp án
Xem đáp án
Đáp án B
Gọi x, y là số mol NaCl và NaI trong hh X
m(X) = m(NaCl) + m(NaI) = 58,5x + 150y = 104,25g (1)
Sục khí Cl2 dư vào dd A:
NaI + Cl2 → I2 + NaCl
y → y
mmuối = m(NaCl) = 58,5.(x+y) = 58,5g
→ x + y = 1mol (2)
Giải hệ PT (1), (2) ta được: x = 0,5 mol và y = 0,5 mol
mNaCl = 0.5.58,5 = 29,25 (g)
Câu 10:
Hoà tan 11,2 lít khí HCl (đktc) vào m gam dung dịch HCl 16%, thu được dung dịch HCl 20%. Giá trị của m là :
 Xem đáp án
Xem đáp án
Đáp án C
nHCl = 0,5 (mol), mHCl thêm vào = 0,5.36,5 = 18,25 (g)
=> mHCl (trong dung dịch 16%) = 0,16mdd
Sau khi thêm 11,2 lít khí Cl2
=> mdd = 365 (g)
Câu 11:
Hoà tan V lít khí HCl (đktc) vào 185,4 gam dung dịch HCl 10% thu được dung dịch HCl 16,57%. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án B
![]()
=> mHCl = 18,54 (g)
Gọi số mol HCl thêm vào = x (mol)
![]()
=> x= 0,4 (mol), VHCl = 0,4.22,4 = 8,96 lít
Câu 13:
Hàng năm thế giới cần tiêu thụ khoảng 45 triệu tấn clo. Nếu dùng muối ăn để điều chế clo thì cần bao nhiêu tấn muối (Giả thiết hiệu suất phản ứng đạt 100%) ?
 Xem đáp án
Xem đáp án
Đáp án B
2NaCl + 2H2O → Cl2 + H2 +2NaOH
2.58,5 → 71 gam
m → 45 triệu tấn
Câu 14:
Cho các phản ứng sau:
(1). Cl2 + 2NaBr → 2NaCl + Br2
(2). Br2 + 2NaI → 2NaBr + I2
(3). Cl2 + 2NaF → 2NaCl + F2
(4). Br2 + 5Cl2 + 6H2O → 2HBrO3 + 10HCl
(5). F2 + 2NaCl → 2NaF + Cl2
(6). HF + AgNO3 → AgF + HNO3
(7). HCl + AgNO3 → AgCl + HNO3
(8). PBr3 + 3H2O → H3PO3 + 3HBr
Số phương trình hóa học viết đúng là :
 Xem đáp án
Xem đáp án
Đáp án C
Các phương trình viết đúng là: (1); (2); (4); (7); (8).
Câu 15:
Cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất. Phần trăm thể tích của clo trong Y là
 Xem đáp án
Xem đáp án
Đáp án A
Ta có mX + mY = mZ 7,8 + mY = 19,7
mY = 11,9 (g)
Gọi
Ta có x + y = = 0,25 (mol) (1)
= 71x + 32y = 11,9 (2)
Giải (1) và (2) ta có x = 0,1 (mol); y = 0,15(mol)
Câu 16:
Cho 12,1 g hỗn hợp Zn, Fe tác dụng với vừa đủ với m g dd HCl 10%. Cô cạn dd thu được 19,2 g muối. Giá trị m là:
 Xem đáp án
Xem đáp án
Đáp án A
mmuối = mKL + mgốc axit 19,2 = 12,1 + mCl-
= nHCl
m = 73 g
Câu 17:
Có 5 gói bột tương tự nhau là CuO, FeO, MnO2, Ag2O, (Fe + FeO). Có thể dùng dung dịch nào trong các dung dịch nào dưới đây để phân biệt 5 chất trên?
 Xem đáp án
Xem đáp án
Đáp án C
CuO + 2HCl →CuCl2 + H2O
FeO + 2HCl →FeCl2 + H2O
MnO2 + 4HCl →MnCl2 + Cl2 ↑ + 2H2O
Ag2O + 2HCl →2AgCl ↓ + H2O
Fe + 2HCl → FeCl2 + H2 ↑
Câu 18:
Hoà tan 9,14 g hỗn hợp Cu, Mg, Al bằng một lượng vừa đủ dd HCl được 7,84 lít khí H2 (đktc) và 2,54 g rắn Y và dd Z. Cô cạn dd Z thu được khối lượng muối khan là:
 Xem đáp án
Xem đáp án
Đáp án A
Chất rắn Y là Cu không phản ứng
nHCl = = 2.0,35 = 0,7 mol
mmuối = mKL + mgốc axit = (9,14 – 2,54) + 0,7.35,5 = 31,45 (g)
Câu 19:
Cho 5,85 gam muối NaX tác dụng với dd AgNO3 dư ta thu được 14,35 gam kết tủa trắng. Nguyên tố X có hai đồng vị 35X(x1%) và 37X(x2%). Vậy giá trị của x1% và x2% lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108-23 = 85, m tăng = 8,5
nAgX = 0,1, MAgX = 143,5 => X :35,5(Cl)
ta có: = 35,5 => x = 75%
Câu 20:
Cho 3 lít Cl2 phản ứng với 2 lít H2; hiệu suất phản ứng đạt 80%. Phần trăm thể tích Cl2 trong hỗn hợp khí sau phản ứng là (các thể tích khí được đo ở cùng điều kiện t0, p)
 Xem đáp án
Xem đáp án
Đáp án A
Các thể tích đo trong cùng điều kiện nhiệt độ và áp suất, nên tỉ lệ về thể tích cũng là tỉ lệ về số mol
H2 + Cl2 → 2HCl
Ban đầu 2 3 (l)
Phản ứng 2.0,8 1,6 3,2 (l)
Sau phản ứng 0,4 1,4 3,2 (l)
Vsau phản ứng = 0,4 + 1,4 + 3,2 = 5
Câu 21:
Hỗn hợp X gồm Zn , Mg và Fe. Hòa tan hết 23,40 gam hỗn hợp X vào dung dịch HCl thu được 11,20 lít khí (đktc). Để tác dụng với vừa hết 23,40 gam hỗn hợp X cần 12,32 lít khí Clo (đktc). Khối lượng của Fe trong hỗn hợp là
 Xem đáp án
Xem đáp án
Đáp án D
Bảo toàn e:
+) X + HCl: 2nZn + 2nMg + 2nFe = 2nH2 = 1,0 mol
+) X + Cl2: 2nZn + 2nMg + 3nFe = 2nCl2 = 1,1 mol( khi phản ứng với Cl2, Fe thể hiện hóa trị 3)
⇒ nFe = 1,1 - 1,0 = 0,1 mol ⇒ mFe = 5,6 g
Câu 22:
Hòa tan hoàn toàn 2,45g hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại kiềm thổ đó là
 Xem đáp án
Xem đáp án
Đáp án A
Gọi A, B là kí hiệu của 2 kim loại. X là kí hiệu chung của 2 kim loại
Do dung dịch sau phản ứng có nồng độ mol bằng nhau nên
TH1: Nếu dung dịch chỉ chứa 2 muối
A + 2HCl → ACl2 + H2
a 2a a a
B+ 2HCl → BCl2 + H2
a 2a a a
nHCl = 0,2 × 1,25 = 0,25
⇒ 4a = 0,25 ⇒ a = 0,0625 mol
= 19,6
M(Be) = 9 < 19,6 < MB
19,6 = = 30,2 (loại)
TH2: Vậy dung dịch sau phản ứng có HCl dư
⇒ nHCl(bđ) = 0,25 = 4a + a = 5a
⇒ a = 0,05
= 24,5
Nếu A là Be ⇒ MA = 9
24,5 = = 40 (Ca)
Vậy 2 kim loại là Be và Ca
Câu 23:
Chất A là muối Canxi halogenua. Dung dịch chứa 0,200 gam A tác dụng với lượng dư dung dịch bạc nitrat thì thu được 0,376 gam kết tủa bạc halogenua. Công thức phân tử của chất A là
 Xem đáp án
Xem đáp án
Đáp án C
Gọi công thức muối là CaX2
CaX2 + 2AgNO3 → Ca(NO3)2 +2AgX
40+2X → 2.(108+X) (g)
0,2 → 0,376 (g)
Ta có:
→ X = 80 (Br)
Công thức: CaBr2
Câu 24:
Cho các sơ đồ phản ứng :
Zn + HCl → Khí A + ...
KMnO4 + HCl → Khí B + ...
KMnO4 Khí C + ...
Các khí sinh ra (A, B, C) có khả năng phản ứng với nhau là:
 Xem đáp án
Xem đáp án
Đáp án B
Zn + 2HCl ZnCl2 + H2 (A)
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 8H2O + 5Cl2 (B)
2KMnO4 K2MnO4 + MnO2 + O2(C)
Vậy các cặp khí có thể xảy ra phản ứng là: A và B; A và C.
Câu 25:
Nguyên tử nguyên tố X tạo ion X−. Tổng số hạt (p, n, e) trong X− bằng 116. X là nguyên tử nguyên tố nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án D
X− có tổng số hạt bằng = 116, vậy X có tổng số hạt = 115
Ta có
2p + n = 115 => n = 115 – 2p, thay vào (1) ta có
↔ P ≤ 115 – 2P ≤ 1,52P
Vậy p = 35; X là Br thỏa mãn (do tạo được ion )