100 câu trắc nghiệm Nhóm Halogen nâng cao phần 3 (có đáp án)
-
2072 lượt thi
-
25 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Khi clo tác dụng với kiềm đặc nóng, tạo muối clorat thì có một phần clo bị khử, đồng thời một phần clo bị oxi hóa. Tỉ lệ số nguyên tử clo bị khử và số nguyên tử clo bị oxi hóa là:
 Xem đáp án
Xem đáp án
Đáp án D
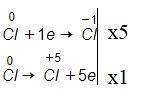
![]()
Câu 2:
Khối lượng HCl bị oxi hóa bởi MnO2 là bao nhiêu, biết rằng khí Cl2 sinh ra trong phản ứng đó có thể đẩy được 12,7g I2 từ dung dịch NaI
 Xem đáp án
Xem đáp án
Đáp án B
Phương trình hóa học của phản ứng
Cl2 + 2NaI → 2NaCl + I2
0,05 ← 0,05 (mol)
nIot = 0,05 mol
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
0,2 ← 0,05 (mol)
Khối lượng HCl cần dùng là: mHCl = 0,2 x 36,5 = 7,3g
Câu 5:
Để hoà tan hết hỗn hợp Zn và ZnO phải dùng 100,8 ml dung dịch HCl 36,5% ( D = 1,19 g/ml ) thu được 0,4 mol khí. Thành phần % về khối lượng hỗn hợp Zn và ZnO ban đầu lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án A
mHCl = 43,78 (g)
nHCl = 1,2 (mol)
Gọi nZn = a, nZnO = b
Zn + 2HCl → ZnCl2 + H2
0,4 0,8 ← 0,4 (mol)
ZnO + 2HCl → ZnCl2 + H2O
0,2 ← 0,4 (mol)
%mZnO = 100% - 61,6% = 38,4%
Câu 6:
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
 Xem đáp án
Xem đáp án
Đáp án B
Fe+2HCl → FeCl2 + H2
a 2a a a
Mg + 2HCl → MgCl2+H2
b 2b b b
mchất rắn X = 56a + 24b;
mddHCl = gam
⇒ mddsau pư = 56a + 24b + 365(a + b) – 2(a + b) = 419a + 387b
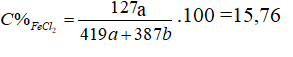
Giải PT ⇒ a = b
⇒
Câu 7:
Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của HCl trong dung dịch đã dùng là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Gọi số mol HCl là x mol
Giả sử KOH hết
⇒ mKCl = 74,5.0,1 = 7,45 gam > 6,525
⇒ KOH dư, HCl hết.
(0,1 – x).56 + x.(39 + 35,5) = 6,525
⇒ x = 0,05 mol ⇒ CM = 0,5M.
Câu 8:
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị II không đổi trong hợp chất) trong hỗn hợp khí X gồm Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án A
mrắn sau − mM = mX ⇒ 71nCl2 + 32nO2 = 23 − 7,2 = 15,8 g (1)
⇒nkhí = nCl2 +nO2 = 0,25 mol (2)
Giải hệ (1) và (2) ⇒ nCl2 = 0,2; nO2 = 0,05 mol
Gọi hóa trị của M là x
Bảo toàn e
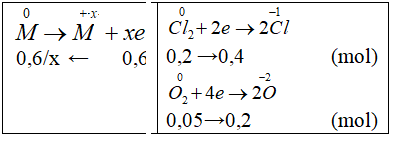
M = 24 (Mg)
Câu 9:
Cho các phản ứng sau
1. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
2. 6HCl + 2Al → 2AlCl3 + 3H2
3. 2HCl + Fe → FeCl2 + H2
4. 14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
5. 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
 Xem đáp án
Xem đáp án
Đáp án B
Trong phương trình 2, 3 HCl đóng vai trò là chất oxi hóa.
Câu 10:
Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Đáp án D
TH 1: Cả hai muối NaX và NaY đều cho kết tủa khi pư với AgNO3
NaZ + AgNO3 → NaNO3 + AgZ↓
a a
Áp dụng pp tăng giảm khối lượng
→ a = 0,03 (mol) → MNaZ= 201→ Z = 178
X và Y là I (127) và At (210), nhưng At không có tự nhiên nên TH này loại
TH 2: Chỉ có 1 muối tạo kết tủa nghĩa là hai muối này là NaF và NaCl
nAgCl = 8,61/143,5 = 0,06 mol
NaCl + AgNO3 → NaNO3 + AgCl↓
0,06 0,06
mY = mNaCl = 0,06.58,5 = 3,51g
mX = mNaF = 6,03 - 3,51 = 2,52g
%NaF = .100% = 41,8%
Câu 11:
Cho 13,44 lít khí clo (ở đktc) đi qua 2,5 lít dung dịch KOH ở 100oC. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là
 Xem đáp án
Xem đáp án
Đáp án B
= 0,6 mol, nKCl = 0,5 mol
Phản ứng với KOH ở 100 độ C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,6 mol 0,5 mol
Từ PT ⇒ Cl2 dư nên số mol KOH tính theo số mol KCl
⇒ nKOH = 0,6 mol ⇒ CM(KOH)= 0,24 M
Câu 12:
Hoà tan hoàn toàn 10,05 gam hỗn hợp 2 muối cacbonat kim loại hoá trị II vào dung dịch HCl thu được dung dịch A và 0,672 lít khí (đktc). Khối lượng muối trong A là
 Xem đáp án
Xem đáp án
Đáp án A
= 0,03 (mol)
MCO3 + 2HCl → MCl2 + H2O + CO2
0,06 ← 0,03 0,03
Bảo toàn khối lượng
mmuối + mHCl = mmuối (A) + mCO2 + mH2O
10,05 + 0,06.36,5 = mmuối (A) + 0,03.44 + 0,03.18 m = 10,38 (g)
Câu 13:
Cho 23,7 gam KMnO4 phản ứng hết với dung dịch HCl đặc (dư), thu được V lít khí Cl2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án B
= 0,15(mol)
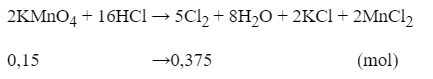
= 0,375.22,4 = 8,4(l)
Câu 14:
Đốt 12,8 g Cu trong bình đựng khí clo. Thể tích khí clo (đktc) tham gia phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án A
nCu = 0,2 (mol)
Cu + Cl2 → CuCl2
0,2 →0,2 (mol)
V = 0,2.22,4 = 4,48 (l)
Câu 15:
Cho 11,3 gam hỗn hợp gồm Mg và Cu tác dụng hết với dung dịch HCl, thấy thoát ra 2,24 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án D
Chất rắn không tan là Cu
= 0,1 (mol)
Mg + 2HCl → MgCl2 + H2
0,1 ← 0,1 (mol)
mMg = 0,1.24 = 2,4 (g)
mCu = 11,3 – 2,4 = 8,9 (g)
Câu 16:
Cho 4,8 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 4,48 lít H2 (đktc). Kim loại đó là ?
 Xem đáp án
Xem đáp án
Đáp án C
Gọi kim loại là R.
= 0,2 (mol)
R + 2HCl → RCl2 + H2
0,2 ← 0,2 (mol)
= 24(Mg)
Câu 17:
Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi n là hóa trị của M.
2M + nCl2 → 2MCln
Theo pt, nM = nmuối
hay
M = 9n
n = 1 M = 9 (loại)
n = 2 M = 18 (loại)
n = 3 M = 27 (Al)
Câu 18:
Hoà tan hoàn toàn 3,80 gam hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp trong dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Hai kim loại kiềm đó là
 Xem đáp án
Xem đáp án
Đáp án A
Gọi hai kim loại kiềm là
2 + 2HCl → 2MCl + H2
0,2 ← 0,1 (mol)
= 19 2 kim loại là Li (7) và Na (23)
Câu 19:
Để tinh chế brom bị lẫn tạp chất clo, người ta dẫn hỗn hợp qua
 Xem đáp án
Xem đáp án
Đáp án A
Cl2 + 2NaBr →2NaCl + Br2
Câu 20:
Cho 300ml một dung dịch có hòa tan 5,85g NaCl tác dụng với 200ml dung dịch có hòa tan 34g , người ta thu được một kết tủa và nước lọc. Nồng độ mol chất còn lại trong nước lọc là? (Cho rằng thể tích nước lọc thu được không thay đổi đáng kể)
 Xem đáp án
Xem đáp án
Đáp án D
nNaCl =0,1 mol, nAgNO3 = 0,2 mol
NaCl + AgNO3 → AgCl + NaNO3
0,1 → 0,1 0,1 (mol)
Vdd = 300 + 200 = 500 ml
(dư) = 0,2 - 0,1 =0, 1 (mol)
= 0,1 mol
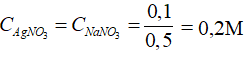
Câu 21:
Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án B
mHCl = 10,95 (g), nHCl = 0,3 (mol)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
0,05 ← 0,3 (mol)
X = 0,05.(27.2 + 16.3) = 5,1(g)
Câu 22:
Trong phản ứng:
K2Cr2O7 + HCl→ CrCl3 + Cl2 + KCl + H2O
Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là
 Xem đáp án
Xem đáp án
Đáp án D
K2Cr2O7 + 14HCl→ 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Số phân tử HCl đóng vai trò chất khử /tổng số phân tử HCl tham gia phản ứng =
Câu 23:
Phản ứng nào sau đây chứng tỏ HCl có tính khử?
 Xem đáp án
Xem đáp án
Đáp án A
Trong phản ứng A, số oxi hóa của Cl tăng từ - 1 lên 0. Vậy HCl đóng vai trò là chất khử.
Câu 24:
Đốt 3,36 gam kim loại M trong khí quyển clo thì thu được 9,75 gam muối clorua. Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án C
Gọi n là hóa trị của M
2M + nCl2 → 2MCln
Theo pt, nM = nmuối
n = 1 M = 56/3 (loại)
n = 2 M = 112/3 (loại)
n = 3 M = 56 (Fe)
Câu 25:
Có các nhận xét sau về clo và hợp chất của clo
1. Nước Gia-ven có khả năng tẩy mầu và sát khuẩn.
2. Cho giấy quì tím vào dung dịch nước clo thì quì tím chuyển màu đỏ sau đó lại mất mầu.
3. Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
4. Trong công nghiệp, Cl2 được điều chế bằng cách điện phân dung dịch NaCl(màng ngăn, điện cực trơ).
Trong các nhận xét trên, số nhận xét đúng là
 Xem đáp án
Xem đáp án
Đáp án B
Nhận định (3) sai, do trong phản ứng với thì HCl đóng vài trò là chất khử.
