125 câu trắc nghiệm Oxi - Lưu huỳnh nâng cao (phần 5) (có đáp án)
-
4270 lượt thi
-
25 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Trộn 3 mol SO2 với 2 mol O2, cho hỗn hợp vào bình xin có chứa sẵn chất xúc tác, bật tia lửa điện để phản ứng xảy ra. Sau phản ứng, đưa bình về điều kiện ban đầu thì thấy áp suất trong bình giảm đi 10%. Vậy hiệu suất của phản ứng trên là:
 Xem đáp án
Xem đáp án
Đáp án C.
Gọi x là số mol oxi đã phản ứng, ta có:
Câu 3:
Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch H2SO4 đặc, nóng, dư. Sau phản ứng thu được V lít SO2 duy nhất (đktc). Giá trị của V là:
 Xem đáp án
Xem đáp án
Đáp án D.
nAl = 0,2 (mol), nCu = 0,1 (mol)
Áp dụng định luật bảo toàn electron có
→ V = 0,4 . 22,4 = 8,96 lít.
Câu 4:
Đốt cháy hoàn toàn 80 gam pirit sắt trong không khí thu được chất rắn A và khí B. Lượng chất rắn A tác dụng vừa đủ với 200g H2SO4 29,4%. Độ nguyên chất của quặng là:
 Xem đáp án
Xem đáp án
Đáp án A.
Phương trình phản ứng
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
0,2 ← 0,6 mol
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
0,4 ← 0,2 0,8 mol
m = 0,4 × 120 = 48g
Câu 5:
Chỉ dùng thêm một thuốc thử nào có thể phân biệt các dung dịch sau: BaCl2, MgSO4, Na2SO3, KNO3, K2S.
 Xem đáp án
Xem đáp án
Đáp án B
Trích mỗi dung dịch một ít làm mẫu thử
Cho dung dịch H2SO4 lần lượt vào các mẫu thử trên
- Mẫu thử nào tạo kết tủa trắng là BaCl2
BaCl2 + H2SO4 → BaSO4 ↓+ 2HCl
- Mẫu thử nào tạo khí mùi hắc là Na2SO3
Na2SO3 + H2SO4 → Na2SO4+ SO2 ↑+ H2O
- Mẫu thử tạo mùi trứng thối là K2S
K2S + H2SO4 → K2SO4 + H2S↑
Cho dung dịch BaCl2 vừa mới nhận được lần lượt vào hai mẫu thử còn lại:
- Mẫu thử nào tạo kết tủa trắng là MgSO4
BaCl2 + MgSO4 → BaSO4↓ + MgCl2
- Mẫu thử không có hiện tượng gì là KNO3
Câu 6:
Sử dụng nước và hóa chất nào sau đây làm thuốc thử, có thể phân biệt các chất bột sau: NaCl, CaCO3, Na2S, K2SO3 , Na2SO4
 Xem đáp án
Xem đáp án
Đáp án A
Cho H2O lần lượt vào các mẫu thử trên
- Mẫu thử không tan trong nước là CaCO3
- Các mẫu thử còn lại ta: NaCl, Na2S, K2SO3, Na2SO4
Cho dung dịch HCl dư lần lượt vào các mẫu thử tan.
- Mẫu thử tạo khí mùi trứng thối là Na2S
Na2S +2 HCl → 2NaCl + H2S↑
- Mẫu thử tạo khí mùi hắc là K2SO3
K2SO3 +2 HCl → 2KCl+ SO2↑+ H2O
- Hai chất không có hiện tượng gì là : NaCl và Na2SO4 (nhóm 1)
Cho dung dịch HCl dư vào chất không tan trong nước, sau đó lây dung dịch vừa thu được lần lượt tác dụng với 2 chất nhóm 1.
- Mẫu thử tạo kết tảu trắng là Na2SO4
CaCl2 + Na2SO4 → CaSO4 + 2NaCl
- Mẫu thử không có hiện tượng gì là NaCl
Câu 7:
Trộn 0,8 mol SO2 với 20,16 lít O2 (đktc) trong bình kín có thể tích không đổi là 100 lít, đun nóng bình đến 400oC, ở nhiệt độ này thấy áp suất trong bình là 0,8 atm. % các chất khí trong bình là:
 Xem đáp án
Xem đáp án
Đáp án D
n sau phản ứng là: 1,7 – x =
x = 0,25 (mol)
%VSO2=
%VSO3 =
%O2 =
Câu 8:
Khi đốt 1 gam hỗn hợp đồng sunfua và kẽm sunfua có chứa 3,2% tạp chất không cháy, thu được một lượng khí có thể làm mất màu 100ml dung dịch iot 0,1M. Thành phần phần trăm theo khối lượng của hai muối sunfua trong hỗn hợp là?
 Xem đáp án
Xem đáp án
Đáp án A.
2CuS + 3O2 → 2CuO + 2SO2 ↑ (1)
a → a mol
2ZnS + 3O2 → 2ZnO + 2SO2 ↑ (2)
b → b mol
SO2 + I2 + 2H2 O → H2SO4 + 2HI (3)
0,01 ← 0,01 mol
Khối lượng của hỗn hợp: ZnS và CuS là:
Gọi a là số mol của CuS và b là số mol của ZnS
Ta có: 96a + 97b = 0,968
a + b = 0,01
a = 0,002, b = 0,008 (mol)
Câu 9:
Đun nóng 4,8 gam bột magie với 4,8 gam bột lưu huỳnh trong điều kiện không có không khí, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X vào dung dịch HCl dư, thu được hỗn hợp khí Y. MY = ?
 Xem đáp án
Xem đáp án
Đáp án C.
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol); nS = 0,15 (mol)
nH2S = nMgS = nS = 0,15 mol;
nH2= nMg (dư) = 0,2 – 0,15 = 0,05 (mol)
MY = = 26
Câu 10:
Dẫn 1,12 lít (đktc) hỗn hợp khí X gồm O2 và O3 đi qua dung dịch KI dư, sau phản ứng thu được 6,35 gam iot. Phần trăm thể tích của ozon trong X là:
 Xem đáp án
Xem đáp án
Đáp án A.nX = 0,05 (mol)nI2 = 0,
025 (mol)
O3 + 2KI +H2O → 2KOH + O2 + I2
0,025 ← 0,025
Câu 11:
Hấp thụ 7,84 lít (đktc) khí H2S vào 64 gam dung dịch CuSO4 10%, sau phản ứng hoàn toàn thu được m gam kết tủa đen. Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án D.
H2S + CuSO4 → CuS + H2SO4
0,35 0,04 0,04 (H2S dư)
m = 0,04.(64+32) = 3,84 (g)
Câu 12:
Đốt cháy hoàn toàn V lít khí H2S (đktc) bằng một lượng oxi vừa đủ thu được khí Y. Hấp thụ hết Y cần vừa đủ 200ml dung dịch KMnO4 1M. Giá trị của V là:
 Xem đáp án
Xem đáp án
Đáp án D.
2H2S + 3O2 → 2SO2 + 2H2O
0,5 0,5 (mol)
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4
0,5 0,2 (mol)
V = 0,5.22,4 =11,2 (lít)
Câu 13:
Cho 5,6 lít (đktc) hỗn hợp khí X gồm H2S và SO2 tác dụng hết với 1,25 lít dung dịch nước brom vừa đủ. Thêm tiếp vào dung dịch sau phản ứng Ba(NO3)2 dư, thu được m gam kết tủa trắng.
Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án C
Câu 14:
Trộn 200 gam dung dịch H2SO4 12% với 300 gam dung dịch H2SO4 40% thu được 500 gam dung dịch H2SO4 a%. Giá trị của a là:
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 15:
Lưu huỳnh tác dụng với dung dịch H2SO4 đặc nóng:
S + H2SO4 → SO2 + H2O.
Trong phản ứng này có tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hoá là:
 Xem đáp án
Xem đáp án
Đáp án A
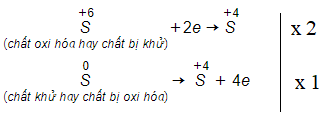
Tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hoá là: 2 : 1
Câu 16:
Hoà tan hoàn toàn m gam hỗn hợp X gồm Li2CO3, K2CO3, Na2CO3 trong dung dịch H2SO4 loãng, dư thu được dung dịch Y và 7,84 lít khí bay ra (đktc). Khi cô cạn dung dịch Y thu được 38,2 muối khan. Giá trị m là:
 Xem đáp án
Xem đáp án
Đáp án A.
Câu 17:
Trong công nghiệp người ta sản xuất axit sunfuric theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4.
Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axit sunfuric từ quặng trên là:
 Xem đáp án
Xem đáp án
Đáp án C.
Ta có sơ đồ:
FeS2 → 2H2SO4120 → 2.98 gam15.80% → m tấn
Giả sử H = 100% → m =
Khối lượng 40% theo lý thuyết thu được là:
Hiệu suất phản ứng:
Câu 18:
Hoà tan hoàn toàn 14,6 gam hỗn hợp kim loại X gồm Al, Zn bằng dung dịch H2SO4 đặc nóng thu được dung dịch Y và thoát ra 12,32 lít khí SO2 (đktc), sản phẩm khử duy nhất. Cô cạn cẩn thận dung dịch Y thu được m gam muối sunfat khan. Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án D.
nSO2 = 0,55 ne = 0,55.2 = 1,1 (mol)
mmuối = mKL + Mgốc axit. = 14,6 + 96. = 67,4 g
Câu 19:
Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 7,84 lít SO2 (đktc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là:
 Xem đáp án
Xem đáp án
Đáp án D.
Gọi nCu = y, nFe = x mol
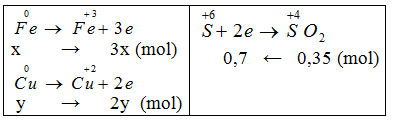
Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 184 (2).
Giải 1,2 ta có: x = 0,1, y = 0,2 (mol)
Câu 20:
Cho hỗn hợp X gồm 0,08 mol mỗi kim loại Mg, Al, Zn vào dung dịch H2SO4 đặc, nóng, dư thu được 0,07 mol một sản phẩm khử duy nhất chứa lưu huỳnh. Xác định sản phẩm khử?
 Xem đáp án
Xem đáp án
Đáp án C.
Bảo toàn e ta có:
nMg.2 + nAl.3 + nZn.2 = nspk.x (x là số e thay đổi của sản phẩm khử)
0,08.2 + 0,08.3 + 0,08.2 = 0,07. x x = 8 Sản phẩm khử là H2S
Câu 21:
Để hoà tan hoàn toàn 2,32 gam hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3) cần dùng vừa đủ V lít dung dịch H2SO4 0,5M loãng. Giá trị của V là :
 Xem đáp án
Xem đáp án
Đáp án C.
Do số mol FeO bằng số mol Fe2O3,
Coi hỗn hợp chỉ có Fe3O4.
Fe3O4 + 4H2SO4 → Fe2(SO4)3 + FeSO4 + 4H2O
0,01 0,04
V = = 0,08 lít
Câu 22:
Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M vừa đủ thu được dung dịch X . Cô cạn dung dịch X thu được lượng muối khan là:
 Xem đáp án
Xem đáp án
Đáp án A.
nHCl = 0,5 (mol), = 0,14 (mol)
m muối = m KL + m gốc axit (Cl, SO4)
= 7,74 + 0,5.35,5 + 0,14.96 = 38,93 (g)
Câu 23:
Hoà tan 19,2 gam kim loại M trong H2SO4 đặc dư thu được khí SO2. Cho khí này hấp thụ hoàn toàn trong NaOH dư, sau phản ứng đem cô cạn dung dịch thu được 37,8 gam muối. Kim loại M là:
 Xem đáp án
Xem đáp án
Đáp án A.
Do NaOH dư nên có phản ứng sau phản ứng chỉ thu được muối trung hòa:
2NaOH + SO2 → Na2SO3 + H2O
0,3 0,3 (mol)
Gọi hóa trị của M là x
Bảo toàn e ta có nM.x = nSO2.2 nM =
MM = 32x, Với x = 2, M = 64 (Cu)
Câu 24:
Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là :
 Xem đáp án
Xem đáp án
Đáp án C
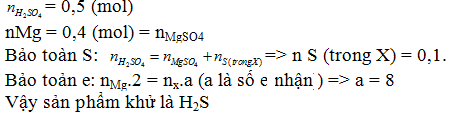
Câu 25:
Hòa tan hoàn toàn 2,52 gam hỗn hợp Mg và Al bằng dung dịch HCl thu được 2,688 lít hiđro (đktc). Cũng lượng hỗn hợp này nếu hòa tan hoàn toàn bằng H2SO4 đặc nóng thì thu được 0,12 mol một sản phẩm X duy nhất hình thành do sự khử S+6. X là:
 Xem đáp án
Xem đáp án
Đáp án B
Bảo toàn e có:
2.nMg+ 3.nAl = 2.
= a.nX
(Với a là số e trao đổi)
2.0,12 = a. 0,12 hay a = 2.
Vậy X là
