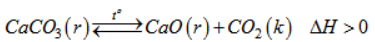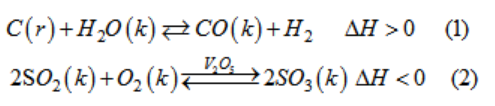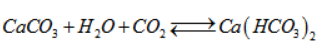Giải SBT Bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
-
584 lượt thi
-
17 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 7:
Cho các phản ứng hoá học :
a) Hãy so sánh các đặc điểm của hai phản ứng hoá học trên.
b) Nêu các biện pháp kĩ thuật để làm tăng hiệu suất sản xuất.
 Xem đáp án
Xem đáp án
a) So sánh các đặc điểm của hai phản ứng hoá học :
| Phản ứng | Giống nhau | Khác nhau |
| (1) | Phản ứng thuận nghịch |
Phản ứng thuận thu nhiệt Phản ứng thuận làm tăng thể tích khí |
| (2) | Phản ứng thuận nghịch |
Phản ứng thuận tỏa nhiệt Phản ứng thuật làm giảm thể tích Cần chất xúc tác |
b) Các biện pháp kĩ thuật để làm tăng hiệu suất sản xuất:
- Đối với phản ứng (1) : Tăng nhiệt độ, tăng nồng độ của hơi nước.
- Đối với phản ứng (2) : Nếu giảm nhiệt độ, cân bằng chuyển sang chiều thuận, tuy nhiên ở nhiệt độ thấp tốc độ của phản ứng thấp làm cho quá trình sản xuất không kinh tế. Người ta chọn nhiệt độ thích hợp, dùng chất xúc tác V2O5và tăng áp suất chung của hệ phản ứng.
Câu 8:
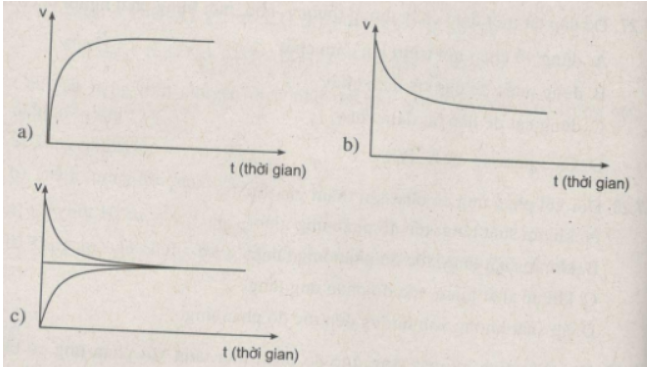
Đồ thị nào sau đây biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian ? Sự biến đổi tốc độ phản ứng nghịch theo thời gian ? Trạng thái cân bằng hoá học ?
 Xem đáp án
Xem đáp án
Đồ thị a biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian.
Đồ thị b biểu diễn sự biến đổi tốc độ phản ứng nghịch theo thời gian.
Đồ thị c biểu diễn trạng thái cân bằng hoá học.
Câu 9:
Vì sao không nển để than đá hay giẻ lau máy đã qua sử dụng thành một đống lớn ?
 Xem đáp án
Xem đáp án
Phản ứng oxi hoá than đá (dầu, mỡ lau máy) ở nhiệt độ thường mặc dù diễn ra rất chậm, nhưng là phản ứng hoá học toả nhiệt. Nhiệt toả ra tích tụ lại làm tăng nhiệt độ của đống than (giẻ lau máy) đến điểm cháy, gây hoả hoạn rất nguy hiểm.
Câu 10:
Trong vòng 100 năm qua, nhiệt độ trung bình của Trái Đất đã tăng thêm 0,6 °C. Nguyên nhân chính của hiện tượng này là do sự tăng nồng độ khí cacbon đioxit (CO2) trong khí quyển, gây ra hiệu ứng nhà kính. Tương tự hiệu ứng giữ ấm cho thực vật trong các nhà kính trồng rau mùa đông ở vùng ôn đới.
Mặc dù lượng khí CO2 do công nghiệp thải ra hàng năm rất lớn, tăng nhanh, nhưng tại sao nồng độ của chất khí này trong khí quyển tăng chậm ?
 Xem đáp án
Xem đáp án
Hai lí do chính :
Trong lòng biển và đại dương tồn tại cân bằng hoá học :
Theo nguyên lí chuyển dịch cân bằng, khi nồng độ cacbon đioxit tăng thì cân bằng hoá học chuyển theo chiều thuận, do đó làm giảm nồng độ của cacbon đioxit.
- Sự quang hợp của cây xanh trên lục địa và của tảo ở biển và các đại dương :
Dù cho có những quá trình tự điều tiết, khống chế sự tăng cacbon đioxit, nhưng con người đang thải lượng cacbon đioxit ngày càng nhiều hơn, vượt quá khả năng tự điều chỉnh của thiên nhiên.
Câu 11:
Trong nước ngầm thường có ion Fe2+dưới dạng muối sắt (II) hiđrocacbonat và sắt (II) hiđroxit. Nước sinh hoạt có chứa ion Fe2+ảnh hưởng xấu đến sức khoẻ của con người. Để loại bỏ ion Fe2+một cách đơn giản, rẻ tiền, người ta dùng oxi không khí oxi hoá ion Fe2+, thành hợp chất chứa ion Fe3+(ít tan trong nước) rồi lọc để thu nước sạch. Để tăng tốc độ của phản ứng oxi hoá ion Fe2+ người ta sử dụng biện pháp kĩ thuật nào ? Giải thích.
 Xem đáp án
Xem đáp án
Để tăng tốc độ của phản ứng oxi hoá Fe2+, người ta sử dụng giàn mưa. Nước ngầm sau khi hút lên bể chứa được đưa qua giàn mưa với mục đích tăng diện tích tiếp xúc của nước với oxi không khí.
Câu 12:
Gần đây, khi thám hiểm Nam Cực, các nhà khoa học đã tìm thấy những đồ hộp do các đoàn thám hiểm trước để lại. Mặc dù đã qua hàng trăm năm, nhưng các thức ăn trong những đồ hộp đó vẫn trong tình trạng tốt, có thể ăn được. Hãy giải thích và liên hệ với viộc bảo quản thực phẩm bằng cách ướp đá.
 Xem đáp án
Xem đáp án
Nam Cực là nơi lạnh nhất Trái Đất. Nhiệt độ ở vùng này có thể xuống hàng chục độ dưới không. Ở nhiệt độ đó, các phản ứng hoá học phân huỷ thức ăn hầu như không xảy ra. Điều này giải thích vì sao đã qua hàng trăm năm, nhưng các thức ăn trong những đồ hộp đó vẫn trong tình trạng tốt, có thể ăn được. Để giảm tốc độ phản ứng phân huỷ thức ăn, người ta bảo quản thực phẩm bằng cách ướp đá.
Câu 13:
Trong phòng thí nghiệm, để tăng tốc độ của một số phản ứng hoá học, ngoài các biện pháp như tăng nồng độ, nhiệt độ, người ta còn dùng máy khuấy. Tác dụng của máy khuấy là gì ?
 Xem đáp án
Xem đáp án
Máy khuấy là một thiết bị cho phép tăng tốc độ khuếch tán của các chất tham gia phản ứng, do đó tăng khả năng tiếp xúc của các chất và tăng tốc độ phản ứng hoá học. Người ta thường dùng máy khuấy trong trường hợp phản ứng giữa các chất lỏng khác nhau, hay phản ứng giữa chất lỏng và chất rắn.
Câu 14:
Làm thế nào để điều khiển các phản ứng hoá học theo hướng có lợi nhất cho con người ?
 Xem đáp án
Xem đáp án
Trước hết cần biết rõ đặc điểm của phản ứng hoá học :
+ Phản ứng một chiều hay thuận nghịch ?
+ Phản ứng thu nhiệt hay toả nhiệt ?
+ Phản ứng có sự tăng thể tích khí hay giảm thể tích khí ?
+ Phản ứng cần chất xúc tác hay không ?
+...
Căn cứ vào đặc điểm của phản ứng để tác động theo hướng tăng tốc độ phản ứng, chuyển dịch cân bằng theo chiều có lợi nhất.
Câu 15:
Nồng độ các chất tham gia phản ứng có ảnh hưởng như thế nào đến tốc độ phản ứng khi các chất sau đây tác dụng với nhau ?
a) CaCO3 + HCl →
b) H2 + Cl2 →
c) Fe3O4 + H2 →
 Xem đáp án
Xem đáp án
a) CaCO3 + 2HCl → CaCl2 + H2O + CO2
Khi dung dịch HCL có nồng độ càng lớn thì tốc độ phản ứng càng lớn.
b) H2 + Cl2 → 2HCl
Khi nồng độ (áp suất) các khí càng lớn thì tốc độ phản ứng càng lớn.
c) Fe3O4 + 4H2 →3Fe + 4H2O
Chỉ có nồng độ (áp suất) của H2 ảnh hưởng đến tốc độ phản ứng vì Fe3O4 là chất rắn. Nồng độ (áp suất) của H2 tăng thì tốc độ phản ứng tăng
Câu 16:
Cho phản ứng :
3O2 ↔ 2O3
Nồng độ ban đầu của O2 là 0,24 mol/lít, sau 5 giây, nồng độ của O2 còn là 0,02 mol/lít. Hãy tính tốc độ của phản ứng trong thời gian đó.
 Xem đáp án
Xem đáp án
Tốc độ phản ứng :
V = (0,04 - 0,02)/5 = 0,008 mol/s
Câu 17:
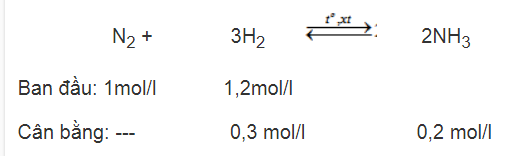
Thực hiện phản ứng tổng hợp amoniac :
N2 + 3H2 ↔ 2NH3
Nồng độ mol ban đầu của các chất như sau :
[N2] = 1 mol/l ; [H2] = 1,2 mol/l
Khi phản ứng đạt cân bằng nồng độ mol của [NH3] = 0,2 mol/1. Tính hiệu suất của phản ứng tổng hợp amoniac.
 Xem đáp án
Xem đáp án
Theo PTHH thì 1 mol N2 cần 3 mol H2. Ở đây chỉ có 1,2 mol H2, vì H2 thiếu nên tác dụng hết. Hiệu suất phải tính theo lượng chất tác dụng hết. Số mol H2 đã tác dụng là 0,3 mol.
Vậy h = (0,3 : 1,2). 100 = 25
Đáp số : h = 25%.