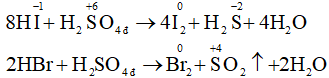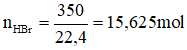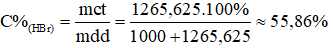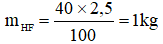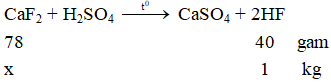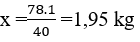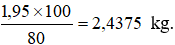Bài 25: Flo - Brom - Iot
-
2959 lượt thi
-
11 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Dung dịch axit nào sau đây không thể chứa trong bình thủy tinh:
 Xem đáp án
Xem đáp án
D đúng
Vì
Do đó được dùng để khắc chữ lên thủy tinh
Câu 2:
Đổ dung dịch chứa 1g HBr vào dung dịch chứa 1g NaOH. Nhúng giấy quỳ tím vào dung dịch thu được thì giấy quỳ tím chuyển sang nàu nào sau đây:
 Xem đáp án
Xem đáp án
B đúng.
= 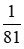
= 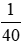
(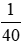
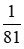
⇒ nhúng giấy quỳ vào dung dịch thu được giấy quỳ sẽ chuyển màu xanh.
Câu 3:
So sánh tính chất oxi hóa của các đơn chất và tính khử của những hợp chất HF, HCl, HBr, HI. Dẫn ra những phương trình hóa học để minh họa.
 Xem đáp án
Xem đáp án
Tính oxi hóa giảm dần từ đến .
- Flo là phi kim mạnh nhất, oxi hóa được tất cả các kim loại kể cả vàng và platin. Clo, Br và Iot tác dụng được với một số kim loại.
- Phản ứng với hiđro.
- Halogen đứng trước đẩy halogen đứng sau ra khỏi muối của chúng:
Tính khử của axit tăng theo chiều: HF < HCl < HBr < HI.
- Chỉ có thể oxi hóa F- bằng dòng điện. Còn ion đều có thể bị oxi hóa khi tác dụng với chất oxi hóa mạnh.
- HF hoàn toàn không thể hiện tính khử, HCl chỉ thể hiện tính khử khi tác dụng với những chất oxi hóa mạnh, còn HBr và nhất là HI có tính khử mạnh. Axit sunfuric đặc bị HBr khử đến và bị HI khử đến :
Câu 4:
Phản ứng của các đơn chất halogen với nước xảy ra như thế nào? Viết phương trình phản ứng, nếu có?
 Xem đáp án
Xem đáp án
Khi tan trong nước, các halogen tác dụng với nước, flo phản ứng mãnh liệt với nước giải phóng oxi.
2 + 2 → 4HF + .
Với brom và clo thì phản ứng xảy ra theo hướng khác, brom tác dụng với nước chậm hơn.
+ ⇆ HBr + HBrO.
+ ⇆ HCl + HClO
Iot không phản ứng với nước
Câu 5:
Muối NaCl có lẫn tạp chất là NaI.
a) Làm thế nào để chứng minh rằng trong muối NaCl nói trên có lẫn tạp chất NaI?.
b) Làm thế nào để có NaCl tinh khiết.
 Xem đáp án
Xem đáp án
a) Để chứng minh rằng trong muối NaCl có lẫn tạp chất NaI, người ta sục khí clo vào dung dịch muối NaCl có lẫn tạp chất NaI, nếu có kết tủa màu đen tím tác dụng với hồ tinh bột tạo thành hợp chất màu xanh thì chứng tỏ trong muối NaCl có lẫn tạp chất NaI.
b) Để thu được NaCl tinh khiết, người ta sục khí clo dư vào dung dịch NaCl có lẫn tạp chất NaI, lọc kết tủa (hoặc đun nonngs iot rắn biến thành hơi) được NaCl tinh khiết trong dung dịch nước lọc.
(màu đen tím).
Câu 6:
Sẽ quan sát được hiện tượng gì khi ta thêm dần dần nước clo vào dung dịch kali iotua có chứa sẵn một ít hồ tinh bột? Dẫn ra phương trình phản ứng mà em biết.
 Xem đáp án
Xem đáp án
- Nước clo:
- oxi hóa thành
- Do đó dung dịch chuyển sang màu xanh do iot tác dụng với hồ tinh bột.
- Sau đó màu xanh của hồ tinh bột và iot cũng bị mất màu do HClO có tính oxi hóa mạnh, axit này làm mất màu xanh của tinh bột và iot.
Câu 7:
Ở điều kiện tiêu chuẩn, 1 lít nước hòa tan 350 lít khí HBr. Tính nồng độ phần trăm của dung dịch axit bromhiđric thu được.
 Xem đáp án
Xem đáp án
→ = 15,625 x 81 = 1265,625g;
= 1 lít ⇒ = 1000g.
Câu 8:
Cho 1,03 gam muối natri halogenua (A) tác dụng với dung dịch dư thì thu được một kết tủa, kết tủa này sau khi phân hủy hoàn toàn cho 1,08 gam bạc. Xác định tên muối A.
 Xem đáp án
Xem đáp án
= 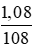
Phương trình hóa học của phản ứng:
Đặt X là kí hiệu, nguyên tử khối của halogen
0,01mol 0,01mol
0,01mol 0,01mol
Theo pt: = 0,1 mol
= 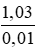
Muối A có công thức phân tử là NaBr
Câu 9:
Tính khối lượng cần dùng để điều chế 2,5kg dung dịch axit flohidric nồng độ 40%. Biết hiệu suất phản ứng là 80 %.
 Xem đáp án
Xem đáp án
Phương trình hóa học của phản ứng:
cần dùng:
Câu 10:
Làm thế nào để phân biệt dung dịch NaF và dung dịch NaCl?
 Xem đáp án
Xem đáp án
Cho dung dịch AgNO3 vào 2 mẫu thử chứa dung dịch NaF và dung dịch NaCl, mẫu thử nào có kết tủa trắng NaCl, mẫu thử còn lại không tác dụng là NaF.
+ NaF → không phản ứng (AgF dễ tan trong nước).
+ NaCl → AgCl↓ + .
Câu 11:
Iot bị lẫn tạp chất là NaI. Làm thế nào để loại bỏ tạp chất đó.
 Xem đáp án
Xem đáp án
Hòa tan iot bị lẫn tạp chất NaI vào nước, sau đó sục khí clo vào dung dịch để oxi hóa thành để tận thu ta đun nóng nhẹ ở áp suất khí quyển, thăng hoa thành hơi màu tím
+ +