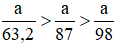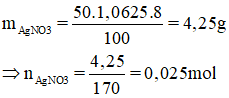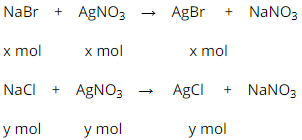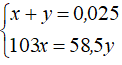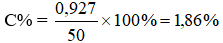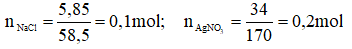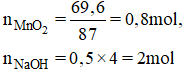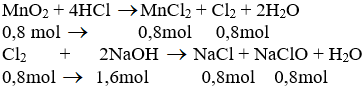Bài 26: Luyện tập : Nhóm halogen
-
2968 lượt thi
-
13 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 2:
Đổ dung dịch vào dung dịch muối nào sau đây sẽ không có phản ứng:
 Xem đáp án
Xem đáp án
A. NaF không phản ứng
Câu 5:
Một nguyên tố halogen có cấu hình electron lớp ngoài cùng của nguyên tử là .
a) Viết cấu hình electron nguyên tử đầy đủ của nguyên tử.
b) Tên, kí hiệu và cấu tạo phân tử của nguyên tố hóa học này.
c) Nêu tính chất hóa học cơ bản của nguyên tố này và dẫn ra những phản ứng hóa học để minh họa.
d) So sánh tính chất hóa học của nguyên tố này với 2 nguyên tử halogen khác đứng trên và dưới nó trong nhóm halogen và dẫn ra phản ứng hóa học để minh họa.
 Xem đáp án
Xem đáp án
a) Halogen có cấu hình electron lớp ngoài cùng của nguyên tử là , cấu hình electron đầy đủ là : .
b) Tên nguyên tố là brom, kí hiệu là Br, công thức phân tử là .
c) Tính chất hóa học cơ bản của nguyên tố này là tính oxi hóa.
- Brom phản ứng với nhiều kim loại.
- Brom tác dụng với nước tương tự clo nhưng khó khăn hơn.
⇆ .
- Brom thể hiện tính khử khi tác dụng với chất oxi hóa mạnh
- Brom có thể oxi hóa muối iotua thành iot
d) So sánh tính chất hóa học của brom với clo và iot.
Brom có tính oxi hóa yếu hơn clo nhưng mạnh hơn iot nên:
+ +
+ + .
Câu 6:
Có những chất sau: và dung dịch HCl.
a) Nếu các chất oxi hóa có khối lượng bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
b) Nếu chất oxi hóa có số mol bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
Hãy trả lời bằng cách tính toán trên cơ sở của các phương trình phản ứng.
 Xem đáp án
Xem đáp án
a) Giả sử lấy lượng mỗi chất là a gam
Ta có:
Lượng điều chế được từ pt (2) nhiều nhất.
Vậy dùng điều chế được nhiều hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) = a mol
Theo (2) = 2,5a mol
Theo (3) = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng điều chế được từ pt (3) nhiều nhất.
Vậy dùng được nhiều hơn.
Câu 7:
Tính khối lượng HCl bị oxi hóa bởi , biết rằng khí sinh ra trong phản ứng đó có thể đẩy được 12,7g từ dung dịch NaI.
 Xem đáp án
Xem đáp án
= 0,05 mol.
Theo pt: = 0,05 mol.
= 4. 0,05 = 0,2 mol.
Khối lượng HCl cần dùng là: = 0,2 x 36,5 = 7,3g.
Câu 8:
Nêu các phản ứng chứng minh rằng tính oxi hóa của clo mạnh hơn brom và iot
 Xem đáp án
Xem đáp án
Clo oxi hóa dễ dàng ion trong dung dịch muối bromua và trong dung dịch muối iotua:
Câu 9:
Để điều chế flo, người ta phải điện phân dung dịch KF trong hidro florua lỏng đã loại bỏ hết nước. Vì sao phải tránh sự có mặt của nước?
 Xem đáp án
Xem đáp án
Khi điện phân hỗn hợp KF trong HF lỏng khan (đã được loại bỏ hết nước). Sở dĩ phải tránh sự có mặt của nước vì flo tác dụng với nước cho thoát ra .
2 + 2 → 4HF +
Phản ứng thật ra rất phức tạp : đầu tiên có phản ứng hóa học:
+ → 2HF + O
Một số nguyên tử oxi kết hợp với flo cho . Như vậy ta điều chế không được flo nguyên chất.
Câu 10:
Trong một dung dịch có hòa tan 2 muối là NaBr và NaCl. Nồng độ phần trăm của mỗi muối trong dụng dịch đều bằng nhau và bằng C%. Hãy xác định nồng độ C% của 2 muối trong dung dịch biết rằng 50g dung dịch hai muối nói trên tác dụng vừa đủ với 50ml dung dịch 8%, có khối lượng riêng D = 1,0625 g/.
 Xem đáp án
Xem đáp án
Phương trình hóa học của phản ứng:
Biết nồng độ phần trăm của mỗi muối trong dung dịch bằng nhau và khối lượng dung dịch là 50g, do đó khối lượng NaCl bằng khối lượng NaBr.
Gọi .
Theo pt:
⇒
Ta có hệ phương trình đại số:
Giải ra, ta có x ≈ 0,009 mol
→ = 103 x 0,009 = 0,927g
Câu 11:
Cho 300ml một dung dịch có hòa tan 5,85g NaCl tác dụng với 200ml dung dịch có hòa tan 34g , người ta thu được một kết tủa và nước lọc.
a) Tính khối lượng chất kết tủa thu được.
b) Tính nồng độ mol chất còn lại trong nước lọc. Cho rằng thể tích nước lọc thu được không thay đổi đáng kể
 Xem đáp án
Xem đáp án
a) Phương trình hóa học của phản ứng:
Theo pt: = 0,1 mol
b) = 300 + 200 = 500 ml
dư = 0,2 – 0, 1 = 0,1 mol; = 0,1 mol
= 0,2 mol/l.
Câu 12:
Cho 69,6g tác dụng với dung dịch HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dung dịch NaOH 4M (ở nhiệt độ thường).
a) Viết phương trình hóa học của phản ứng xảy ra.
b) Xác định nồng độ mol/l của những chất có trong dung dịch sau phản ứng. Biết rằng tinh thể của dung dịch sau phản ứng thay đổi không đáng kể
 Xem đáp án
Xem đáp án
a) Phương trình hóa học của phản ứng:
b) Theo pt (1): = 0,8 mol
Theo pt (2): = 0,8 mol
pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
= 1,6 mol/ lit
= 0,8 mol/ lit
Câu 13:
Khí oxi có lẫn tạp chất là khí clo. Làm thế nào để loại bỏ tạp chất đó.
 Xem đáp án
Xem đáp án
Cho hỗn hợp khí qua dung dịch NaOH, khi clo tác dụng với dung dịch NaOH, ta thu được khí O2.
.