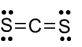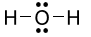Trắc nghiệm Hóa 10 Dạng 1. Câu hỏi lí thuyết Liên kết hóa học có đáp án
-
2013 lượt thi
-
42 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
Trong các hợp chất sau đây, hợp chất nào có liên kết ion?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Hợp chất NaCl được hình thành giữa kim loại điển hình và phi kim điển hình nên có liên kết ion.
Câu 2:
Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện. Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết ³ 1,7 thì đó là liên kết
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết ³ 1,7 thì đó là liên kết ion.
Câu 3:
Trong các phản ứng hoá học, các nguyên tử kim loại có khuynh hướng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong phản ứng hóa học các nguyên tử kim loại có khuynh hướng nhường electron để đạt cấu hình electron bền vững giống khí hiếm gần nhất. Số electron nhường thường là 1, 2, 3 electron.
Câu 4:
Cho 2 nguyên tử có cấu hình electron ở trạng thái cơ bản như sau: 1s22s1 và 1s22s22p5. Hai nguyên tử này kết hợp nhau bằng loại liên kết gì để tạo thành hợp chất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết được hình thành là liên kết ion vì 2 nguyên tử 1s22s1 là kim loại điển hình (Li) và 1s22s22p5 là phi kim điển hình (F).
Câu 5:
Ion X- có cấu hình electron là 1s22s22p6, nguyên tử Y có số electron ở các phân lớp s là 5. Liên kết giữa X và Y thuộc loại liên kết nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
X + 1e → X-
Từ ion X- suy ra cấu hình electron của X là 1s22s22p5 là phi kim điển hình fluorine.
Nguyên tử Y có số electron ở các phân lớp s là 5 nên có cấu hình electron: 1s22s22p63s1. Vậy Y là kim loại điển hình Na (sodium).
Do đó liên kết giữa chúng là liên kết ion.
Câu 6:
Liên kết ion tạo thành giữa hai nguyên tử
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết ion là liên kết được hình thành từ kim loại điển hình và phi kim điển hình.
Câu 7:
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là liên kết cộng hóa trị.
Câu 8:
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung có đặc điểm nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung bị lệch về một phía của nguyên tử.
Câu 9:
Cho các phát biểu sau về hợp chất ion:
(1) Không dẫn điện khi nóng chảy.
(2) Dễ hòa tan trong các dung môi hữu cơ.
(3) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(4) Khó tan trong nước.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phát biểu (1) sai vì hợp chất ion dẫn điện khi nóng chảy.
Phát biểu (2) sai vì hợp chất ion khó hòa tan trong các dung môi hữu cơ.
Phát biểu (3) đúng hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Phát biểu (4) sai vì các hợp chất ion dễ tan trong nước.
Câu 10:
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số chất có liên kết cộng hóa trị phân cực là NH3, HCl, H2O
Loại N2 và H2 vì là liên kết cộng hóa trị không phân cực (liên kết hình thành giữa các nguyên tử giống nhau).
Loại NaCl vì là liên kết ion (liên kết hình thành giữa kim loại điển hình và phi kim điển hình).
Câu 11:
Hợp chất có liên kết ion trong phân tử là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong phân tử NH4Cl có chứa liên kết ion giữa cation NH4+ và anion Cl-.
Câu 12:
Nguyên tử nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
X có cấu hình electron: 1s22s22p63s23p64s1 ⇒ X có 1 electron lớp ngoài cùng, là kim loại điển hình nhóm IA.
Y có cấu hình electron: 1s22s22p5 ⇒ Y có 7 electron ở lớp ngoài cùng, là phi kim điển hình nhóm VIIA.
⇒ Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết ion.
Câu 13:
Cho biết các giá trị độ âm điện của nguyên tử các nguyên tố sau: K (0,82); Al (1,61); H (2,20); O (3,44); S (2,58); Br (2,96) và Cl (3,16). Hợp chất nào sau đây có liên kết ion trong phân tử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
|
Hiệu độ âm điện (\(\Delta \chi \)) |
Loại liên kết |
|
\(0,0 \le \Delta \chi < 0,4\) |
Cộng hóa trị không cực |
|
\(0,4 \le \Delta \chi < 1,7\) |
Cộng hóa trị có cực |
|
\(\Delta \chi \ge 1,7\) |
Ion |
SO2: \(\Delta \chi \)= 3,44 – 2,58 = 0,86 \( \Rightarrow \)Liên kết cộng hóa trị có cực
AlCl3: \(\Delta \chi \)= 3,16 – 1,61 = 1,55 \( \Rightarrow \)Liên kết cộng hóa trị có cực
H2O: \(\Delta \chi \)= 3,44 – 2,20 = 1,24 \( \Rightarrow \)Liên kết cộng hóa trị có cực
KBr: \(\Delta \chi \)= 2,96 – 0,82 = 2,14 \( \Rightarrow \)Liên kết ion
Câu 14:
Phát biểu nào sau đây là sai khi nói về liên kết trong phân tử HCl?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phát biểu C sai vì: Liên kết trong phân tử HCl là liên kết cộng hóa trị phân cực, cặp electron dùng chung lệch về phía nguyên tử clo (nguyên tử có độ âm điện lớn hơn).
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Liên kết hóa học trong đó cặp electron dùng chung bị hút lệch về phía nguyên tử có độ âm điện cao hơn được gọi là liên kết cộng hóa trị có cực.
Câu 16:
Nhận xét nào sau đây đúng khi nói về phân tử khí cacbonic (CO2), biết CO2 có cấu trúc thẳng:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết giữa nguyên tử C và nguyên tử O trong phân tử CO2 là liên kết cộng hóa trị có cực, cặp electron dùng chung lệch về phía nguyên tử O, tuy nhiên do phân tử có cấu trúc thẳng nên lực hút cân bằng làm cho phân tử CO2 không cực.
Câu 17:
Liên kết cộng hóa trị không phân cực thường là liên kết giữa:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết cộng hóa trị không phân cực thường là liên kết giữa hai phi kim giống nhau.
Câu 18:
Nhận định sai về hợp chất cộng hóa trị là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các hợp chất cộng hóa trị không phân cực tan ít trong nước, tan tốt trong các dung môi không phân cực.
Câu 19:
Với phân tử NH3 phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phân tử NH3 hình thành bởi liên kết cộng hóa trị giữa nguyên tử N với 3 nguyên tử H, cặp electron dùng chung lệch về phía nguyên tử N.
Hiệu độ âm điện: 3,04 – 2,2 = 0,84.
Câu 20:
Trong phân tử nitrogen, các nguyên tử liên kết với nhau bằng liên kết:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Liên kết trong phân tử nitrogen (N2) được hình thành giữa các nguyên tử giống nhau nên là liên kết cộng hóa trị không có cực.
Câu 21:
Công thức electron nào sau đây là của phân tử H2O?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Vì mỗi nguyên tử H có 1 electron lớp ngoài cùng, còn thiếu 1 electron nữa để có cấu hình bền vững giống khí hiếm He; còn mỗi nguyên tử O có 6 electron ở lớp ngoài cùng còn thiếu 2 electron nữa để có cấu hình bền vững giống khí hiếm Ne nên giữa O và một nguyên tử H chỉ có 1 cặp e chung.
Câu 22:
Công thức electron nào sau đây là của phân tử khí nitrogen?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Vì mỗi nguyên tử N có 5 electron lớp ngoài cùng nên mỗi nguyên tử sẽ có xu hướng góp chung 3 electron để đạt octet.
Công thức electron:

Câu 23:
Công thức được viết dựa trên công thức electron, trong đó mỗi cặp electron chung được thay bằng một gạch nối “–” gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Công thức được viết dựa trên công thức electron, trong đó mỗi cặp electron chung được thay bằng một gạch nối “–” gọi là công thức Lewis.
Câu 26:
Số cặp electron không tham gia liên kết của nguyên tử N trong phân tử NCl3 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Công thức Lewis của NCl3 là:
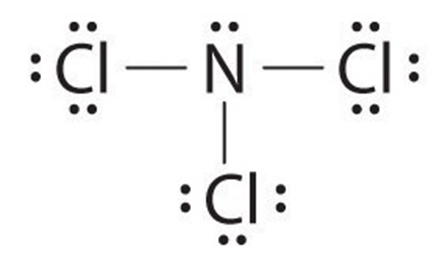
Như vậy N còn 1 cặp electron không tham gia liên kết.
Câu 27:
Công thức Lewis nào sau đây viết sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Công thức Lewis của HCN là:

Câu 28:
Nguyên tử nào sau đây khi hình thành ion có khuynh hướng nhường 1 electron?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tử khi hình thành ion có khuynh hướng nhường 1 electron là K
K → K+ + 1e
Câu 29:
Khi hình thành anion nguyên tử oxygen có xu hướng
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi hình thành anion nguyên tử oxygen có khuynh hướng nhận 2 electron
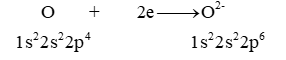
Câu 30:
Hợp chất nào sau đây có liên kết ion?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hợp chất KBr được hình thành nên từ kim loại điển hình và phi kim điển hình nên là hợp chất ion.
K+ + Br- → KBr
Câu 31:
Hợp chất nào sau đây có liên kết cộng hóa trị không phân cực?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Liên kết trong phân tử O2 được hình thành giữa hai nguyên tử giống nhau nên hợp chất này có liên kết cộng hóa trị không phân cực.
Loại B do KCl là hợp chất ion.
Loại C, D do H2O, HF là hợp chất cộng hóa trị phân cực.
Câu 32:
Hợp chất nào sau đây không tạo được liên kết hydrogen liên phân tử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Giữa các phân tử H2O có liên kết hydrogen:
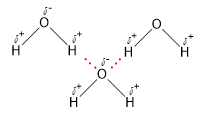
Giữa các phân tử HF có liên kết hydrogen :
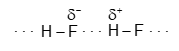
Giữa các phân tử C2H5OH có liên kết hydrogen :
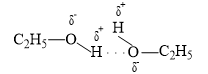
Hợp chất không tạo được liên kết hydrogen liên phân tử là H2S
Câu 33:
Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết hydrogen xuất hiện giữa những phân tử CH3OH
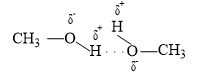
Câu 34:
Cho bảng số liệu sau về tên và công thức của các ion:
|
Tên ion |
Công thức ion |
|
Calcium |
Ca2+ |
|
Nitrate |
NO3- |
|
Phosphate |
PO43- |
Công thức của calcium nitrate là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Công thức của calcium nitrate là Ca(NO3)2.
Câu 35:
Bảng sau cung cấp một số thông tin về các nguyên tố sodium và sulfur
|
Nguyên tố |
sodium (Na) |
sulfur (S) |
|
Số hiệu nguyên tử |
11 |
16 |
Sodium sulfide là một hợp chất ion. Phản ứng tạo thành sodium sulfide nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Giai đoạn 1:
Cấu hình electron [Ne]3s1 [Ne]
Cấu hình electron [Ne]3s23p4 [Ar]
Giai đoạn 2: Cation Na+ và anion S2- hút nhau bằng lực hút tĩnh điện tạo liên kết ion
=> Phản ứng tạo thành sodium sulfide là :
Câu 36:
Potassium chloride là một hợp chất có thể tan trong nước lạnh và có nhiệt độ nóng chảy cao (801oC). Liên kết trong phân tử potassium chloride là gì?
 Xem đáp án
Xem đáp án
Liên kết trong phân tử potassium chloride là liên kết ion.
Giai đoạn 1:
Cấu hình electron [Ar]4s1 [Ar]
Cấu hình electron [Ne]3s23p5 [Ar]
Giai đoạn 2: Cation K+ và anion Cl- hút nhau bằng lực hút tĩnh điện tạo liên kết ion
=> Phản ứng tạo thành sodium chloride:
Câu 37:
Khí nitrogen (N2) rất bền, ở nhiệt độ thường N2 khá trơ về mặt hóa học nên trong một số trường hợp đặc biệt, khí nitrogen được dung để bơm lốp (vỏ) xe thay cho không khí có thể oxi hóa cao su theo thời gian. Vì sao nitrogen lại có đặc tính này?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Vì nitrogen có liên kết ba bền vững, năng lượng liên kết lớn
Cấu hình electron nguyên tử nitrogen (N): [He]2s22p3
Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử N cùng góp chung 3 electron để tạo thành 3 cặp electron chung.
|
Công thức electron |
Công thức cấu tạo theo Lewis |
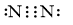 |
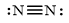 |
Câu 38:
Trong phân tử, các electron chuyển động không ngừng, khi các electron tập trung về một phía sẽ hình thành nên
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong phân tử, các electron chuyển động không ngừng, khi các electron tập trung về một phía sẽ hình thành nên một lưỡng cực tạm thời.
Câu 39:
Vì sao HF có nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết hydrogen mạnh mẽ hơn rất nhiều so với tương tác van der Waals
Giữa các phân tử hydrogen fluoride (HF) có liên kết hydrogen:
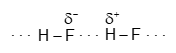
Còn giữa các phân tử HCl cũng như HBr và HI không có liên kết hydrogen.
Điều này giải thích vì sao nhiệt độ sôi của HF cao hơn hẳn so với HCl, HBr, HI.
Câu 40:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu đúng là: Liên kết hydrogen giữa các phân tử H2O mạnh hơn liên kết hydrogen giữa các phân tử C2H5OH.
Phát biểu A sai vì: Tương tác van der Waals yếu hơn liên kết hydrogen.
Phát biểu B sai vì: Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
Phát biểu C sai vì: Sự chuyển động không ngừng của các electron tạo nên các lưỡng cực tạm thời.
Câu 41:
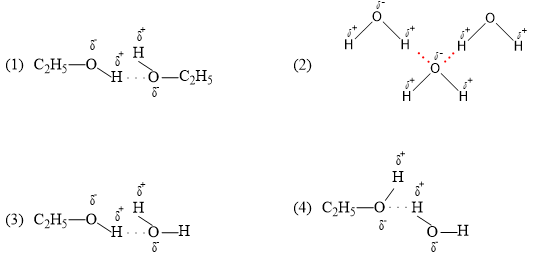
Trong dung dịch ethanol (C2H5OH) có bao nhiêu loại liên kết hydrogen được tạo thành?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong dung dịch ethanol (C2H5OH) có 4 loại liên kết hydrogen.
Câu 42:
Dãy các chất nào sau đây trong phân tử đều có liên kết ion?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dãy các chất trong phân tử có liên kết ion là: K2O, NaCl, CaCl2, MgO.