Trắc nghiệm Hóa 10 Dạng 2. Vận dụng quy tắc octet xác định hướng của nguyên tử khi tham gia liên kết có đáp án
-
2024 lượt thi
-
15 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
Nguyên tử có lớp electron ngoài cùng bền vững là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Lớp electron ngoài cùng bền vững khi bão hòa với 8 electron (trừ He với lớp electron ngoài cùng bão hòa với 2 electron).
Ar (Z = 18) có cấu hình electron: 1s22s22p63s23p6, có 8 electron lớp ngoài cùng.
Vậy Ar có lớp electron ngoài cùng bền vững.
Câu 2:
Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Sodium (Z = 11) có cấu hình electron: 1s22s22p63s1, có 1 electron ở lớp ngoài cùng. Vậy sodium có xu hướng nhường 1 electron để đạt được cấu hình electron bền vững.
Câu 3:
Nguyên tử nguyên tố nào sau đây có xu hướng nhận thêm 2 electron khi hình thành liên kết hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Oxygen (Z = 8) có cấu hình electron: 1s22s22p4, có 6 electron lớp ngoài cùng. Vậy oxygen có xu hướng nhận 2 electron để đạt được cấu hình electron bền vững.
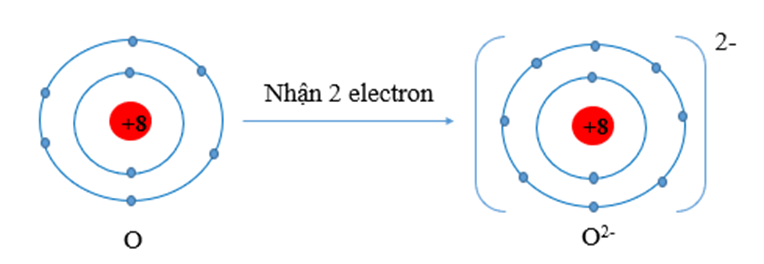
Câu 4:
Nguyên tử Lithium (Z = 3) có xu hướng tạo ra lớp electron ngoài cùng như khí hiếm
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Lithium (Z = 3) có cấu hình electron: 1s22s1, có 1 electron lớp ngoài cùng. Vậy lithium có xu hướng nhường 1 electron tạo ra lớp ngoài cùng bền vững như khí hiếm He.
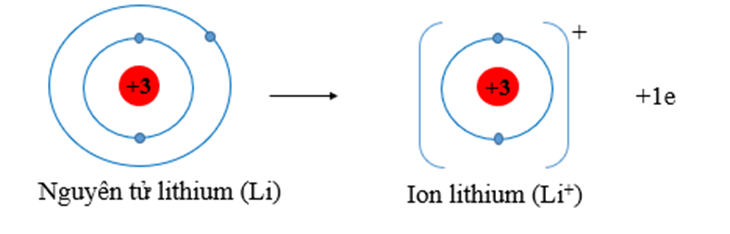
Câu 5:
Nguyên tử X có điện tích hạt nhân là +20. Khi hình thành liên kết hóa học X có xu hướng
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nguyên tử X có điện tích hạt nhân là +20
Cấu hình electron nguyên tử X: 1s22s22p63s23p64s2, có 2 elctron lớp ngoài cùng
Vậy X có xu hướng nhường 2 electron để đạt cấu hình electron bền vững của khí hiếm.
Câu 6:
Nguyên tử Y có xu hướng nhận 3 electron để đạt được lớp electron ngoài cùng bền vững của khí hiếm Ar. Y là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron của Ar: 1s22s22p63s23p6
Nguyên tử Y có xu hướng nhận 3 electron để đạt được lớp electron ngoài cùng bền vững của khí hiếm Ar nên cấu hình electron của Y là: 1s22s22p63s23p3 ⇒ ZY = 15
Vậy Y là phosphorus.
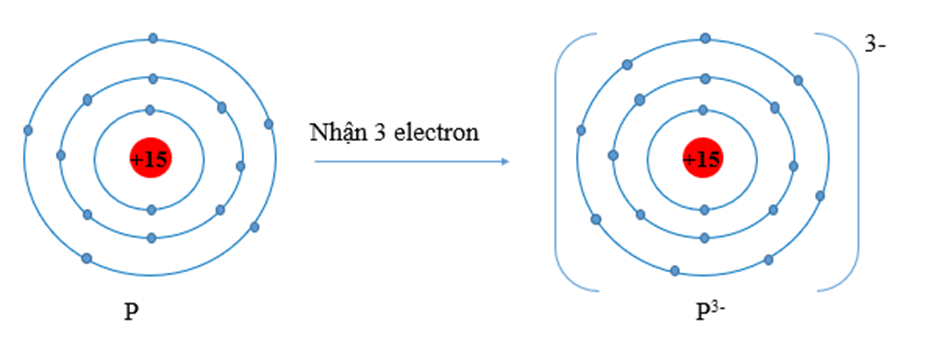
Câu 7:
Khi nguyên tử oxygen nhận thêm 2 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tử oxygen có Z = 8 = số electron. Cấu hình electron nguyên tử O là: 1s22s22p4.
Nguyên tử oxygen nhận thêm 2 electron tạo thành ion O2- có cấu hình electron: 1s22s22p6 giống với khí hiếm Ne.
Câu 8:
Nguyên tử Al (Z = 13) có xu hướng
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron của nguyên tử Al (Z = 13): 1s22s22p63s23p1.
Nguyên tử Al có 3 electron ở lớp ngoài cùng có xu hướng nhường 3 electron để đạt 8 electron ở lớp ngoài cùng bền vững như khí hiếm.
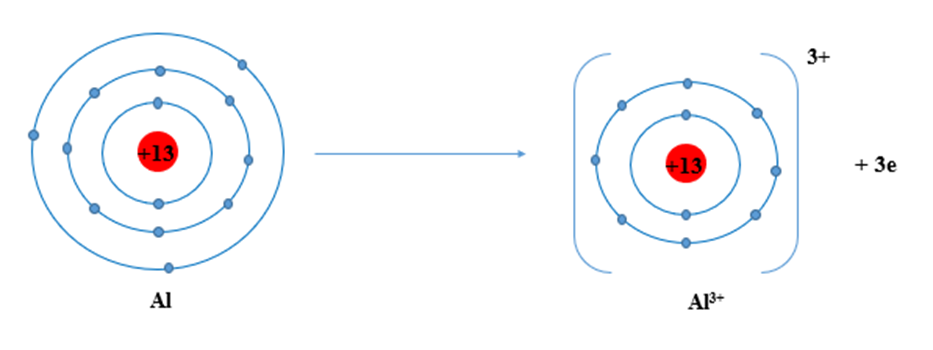
Câu 9:
Khi hình thành liên kết hóa học trong phân tử Cl2, mỗi nguyên tử chlorine
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5.
Khi hình thành liên kết hóa học trong phân tử Cl2, nguyên tử Cl có 7 electron hóa trị, mỗi nguyên tử Cl cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử Cl góp chung 1 electron.
Phân tử Cl2 được biểu diễn:
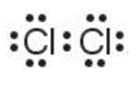
Xung quanh mỗi nguyên tử Cl đều có 8 electron.
Câu 10:
Khi hình thành liên kết hóa học trong phân tử KF:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
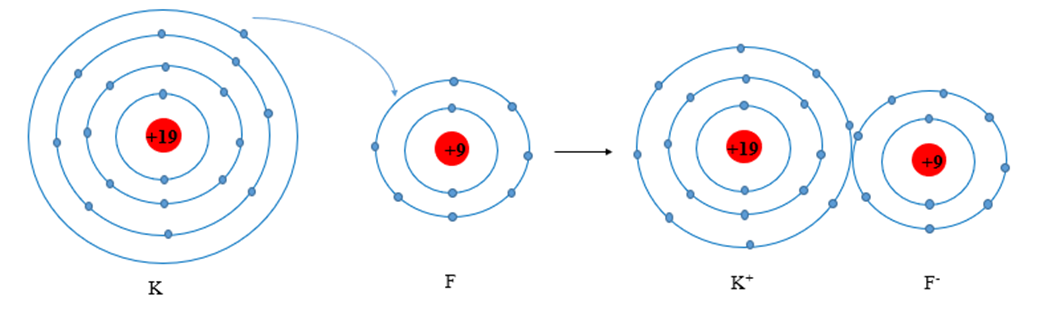
Cấu hình electron của nguyên tử:
K (Z = 19): [Ar]3s1 ® có 1 electron lớp ngoài cùng.
F (Z = 9): 1s22s22p5 ® có 7 electron lớp ngoài cùng.
Khi hình thành liên kết hóa học trong phân tử KF, nguyên tử K có 1 electron hóa trị, nguyên tử F có 7 electron hóa trị, nguyên tử K nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau.
Câu 11:
Phân tử H2 được hình thành từ
 Xem đáp án
Xem đáp án
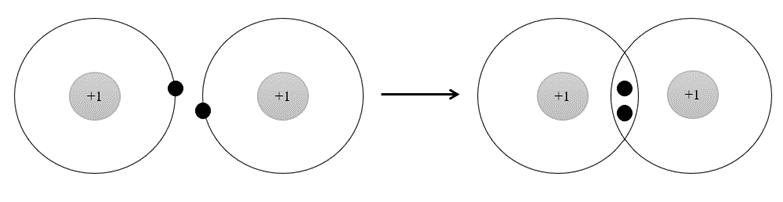
Đáp án đúng là: B
Phân tử H2 được hình thành từ 2 nguyên tử H bởi sự góp chung electron. Sau khi hình thành liên kết, xung quanh mỗi nguyên tử H có 1 đôi electron chung, giống lớp vỏ bền vững của khí hiếm He.
Câu 12:
Khi hình thành liên kết hóa học trong phân tử F2, mỗi nguyên tử fluorine góp chung bao nhiêu electron theo quy tắc octet?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử fluorine có 7 electron hóa trị. Khi hình thành liên kết hóa học trong phân tử F2, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bền vững theo quy tắc octet nên mỗi nguyên tử fluorine góp chung 1 electron.
Câu 13:
Nguyên tử X có 12 proton. Khi hình thành liên kết hóa học X có xu hướng
 Xem đáp án
Xem đáp án
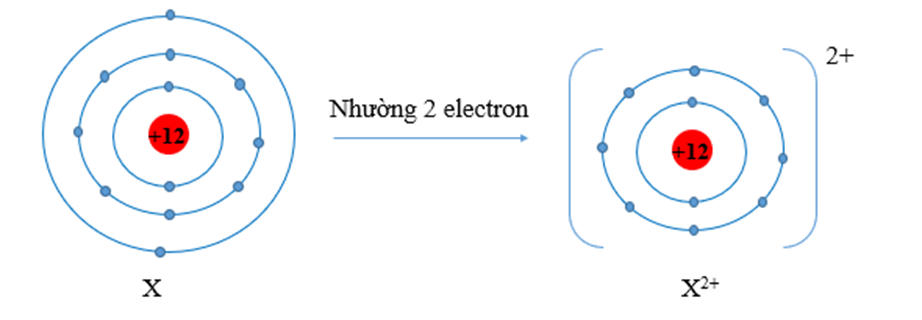
Đáp án đúng là: A
Nguyên tử X có cấu hình electron là: 1s22s22p63s2, có 2 electron lớp ngoài cùng.
Vậy X có xu hướng nhường electron lớp ngoài cùng để có cấu hình electron bền vững giống khí hiếm Ne.
Câu 14:
Nguyên tử X có 9 electron. Ion được tạo thành từ X theo quy tắc octet có số electron là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử X có 9 electron, cấu hình electron: 1s22s22p5.
Vậy X có 7 elctron lớp ngoài cùng, có xu hướng nhận 1 electron để đạt cấu hình electron bền vững của khí hiếm gần nhất.
Do đó ion X− có 9 + 1 = 10 (electron)
Câu 15:
Nguyên tử Y có 7 electron. Ion được tạo thành từ Y theo quy tắc octet có số electron, proton lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nguyên tử Y có số proton = số electron = 7.
Cấu hình electron nguyên tử Y: 1s22s22p3, có 5 elctron lớp ngoài cùng.
Vậy Y xu hướng nhận 3 electron để đạt cấu hình electron bền vững của khí hiếm gần nhất (Ne). Do đó ion X3− có 7 + 3 = 10 (electron); số proton không đổi là 7 proton.
