Trắc nghiệm chuyên đề Hóa 12 Chủ đề 6: Kim loại tác dụng với dung dịch muối có đáp án
Trắc nghiệm chuyên đề Hóa 12 Chủ đề 6: Kim loại tác dụng với dung dịch muối có đáp án
-
382 lượt thi
-
12 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nhúng thanh kim loại kẽm vào một dung dịch chứa hỗn hợp 3,2 gam CuSO4 và 6,4 gam CdSO4. Hỏi sau khi Cu và Cd bị đẩy hoàn toàn khỏi dung dịch thì khối lượng thanh kẽm tăng hay giảm bao nhiêu?
 Xem đáp án
Xem đáp án
Ta có: nCuSO4 = 3,2/160 = 0,02 (mol); nCdSO4 = 6,24/208 = 0,03(mol)
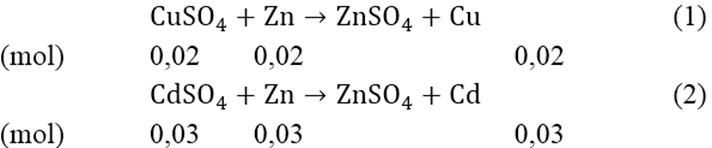
Từ (1) và (2) ⇒ ∑mCu + Cd = (0,02.64) + (0,03.112) = 4,64(gam)
Và mZn tham gia phản ứng = (0,02 + 0,03).65 = 3,25(gam)
Vậy khối lượng thanh Zn tăng: 4,64 - 3,25 = 1,39(gam)
Câu 2:
Ngâm một cái đinh sắt vào 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính nồng độ mol của dung dịch CuSO4 ban đầu.
 Xem đáp án
Xem đáp án
Áp dụng phương pháp tăng giảm khối lượng
Theo phương trình: Fe + CuSO4 → Cu + FeSO4
Cứ 1 mol Fe (56 gam) tác dụng với 1 mol CuSO4 → 1 mol Cu (64 gam).
Khối lượng đinh sắt tăng: 64 – 56 = 8 (gam)
Thực tế khối lượng đinh sắt tăng 0,8 (gam)
Vậy, nCuSO4 phản ứng = 0,8/8 = 0,1(mol)và CMCuSO4 = 0,1/0,2 = 0,5M
Câu 3:
Cho 2,24 gam bột Fe vào 200 ml dung dịch hỗn hợp gồm có AgNO3 0,1M và Cu(NO3)2 0,5M, khuấy đều tới phản ứng hoàn toàn, thu được chất rắn A và dung dịch B.
a) Tính số gam chất rắn A.
b) Tính nồng độ mol của các chất trong dung dịch B.
 Xem đáp án
Xem đáp án
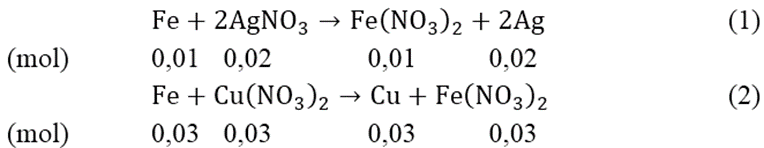
nAgNO3 = 0,02 (mol); nFe = 0,04 (mol); nCu(NO3)2 = 0,1(mol)
nFe phản ứng (1) = 0,01(mol); nFe pư (2) = 0,04 - 0,01 = 0,03 (mol)
nCu(NO3)2dư = 0,1 - 0,03 = 0,07 (mol)
Chất rắn A gồm: 0,02 mol Ag và 0,03 mol Cu
⇒ mA = 0,02.108 + 0,03.64 = 4,08(gam)
Dung dịch B: Fe(NO3)2: 0,04 (mol) ⇒ CM = 0,2 M
Cu(NO3)2: 0,07 (mol) ⇒ CM = 0,35M
Câu 4:
Cho 0,774 gam hỗn hợp Zn và Cu vào 500 ml dung dịch AgNO3 nồng độ 0,04M. Sau khi các phản ứng xảy ra hoàn toàn được chất rắn X nặng 2,288 gam chất rắn. Hãy xác định thành phần của ?
 Xem đáp án
Xem đáp án
Ta có: nAgNO3 = 0,5.0,04 = 0,02(mol)
Thứ tự phản ứng:
Zn + 2AgNO3 → Zn(NO3 )2 + 2Ag (1)
Cu + 2AgNO3 → Cu(NO3 )2 + 2Ag (2)
Nếu Zn, Cu phản ứng hết thì khối lượng kim loại thu được tối đa nặng:
108 . 0,02 = 2,16 (gam) < mX ⇒ kim loại còn dư ⇒ AgNO3 phản ứng hết.
Nếu Cu chưa phản ứng thì phản ứng (1) làm tăng một lượng:
108.0,02 - 65.0,02/2 = 1,51 (gam) tức khối lượng chất rắn lúc đó nặng:
0,774 + 1,51 = 2,284 (gam) < mX ⇒ Cu có phản ứng nhưng còn dư.
Vậy X gồm Ag và Cu.
Câu 5:
Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Vậy khối lượng của vật sau phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án: B
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
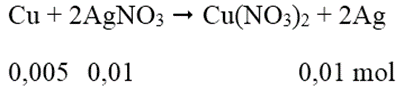
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)
Câu 6:
Nhúng một đinh sắt vào 200ml dung dịch CuSO4 1M. Sau một thời gian lấy đinh sắt ra, sấy khô và đem cân thì thấy khối lượng đinh sắt tăng lên 0,4g. Xem như thể tích dung dịch thay đổi không đáng kể. Vậy nồng độ của CuSO4 còn lại sau phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án: C
Số mol CuSO4 ban đầu là 0,2 mol
Gọi a là số mol Fe phản ứng:

Khối lượng định sắt tăng lên là: 64a - 56a = 8a
Ta có: 8a = 0,4 → a = 0,05 mol
Số mol CuSO4 dư = 0,2 - 0,05 = 0,15 mol → [CuSO4] = 0,75M
Câu 7:
Ngâm một lá Zn trong dung dịch có hòa tan 8,32 gam CdSO4. Phản ứng xong thấy khối lượng là Zn tăng 2,35%. Vậy khối lượng của là Zn trước khi tham gia phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án: C
Số mol CdSO4 = 8,32/208 = 0,04 (mol)
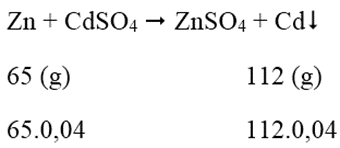
Khối lượng lá Zn tăng: 112.0,4 - 65.0,04 = 1,88 (g)
⇒ Khối lượng lá Zn trước khi phản ứng: 1,88.100/2,35 = 80 (g)
Câu 8:
Ngâm một lá kẽm trong dung dịch chứa 2,24 gam ion kim loại M2+ trong muối sunfat sau phản ứng, khối lượng lá Zn tăng lên 0,94 gam. Vậy M là:
 Xem đáp án
Xem đáp án
Đáp án: D
Phương trình phản ứng:
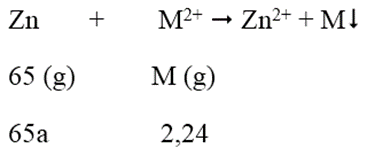
Khối lượng lá Zn tăng: 2,24 - 65a = 0,94 → a = 0,02 mol
M = 2,24/0,02 = 112 → M là Cd
Câu 9:
Lấy hai thanh kim loại M đều có giá trị là 1g. Nhúng thanh thứ nhất vào dung dịch AgNO3 và thanh thứ hai vào dung dịch Cu(NO3)2. Sau một thời gian khối lượng thanh thứ nhất tăng 151%, thanh thứ hia giảm 1% (so với ban đầu). Biết rằng số mol M phản ứng ở hia thanh là như nhau. Vậy M là:
 Xem đáp án
Xem đáp án
Đáp án: C
Phương trình phản ứng:
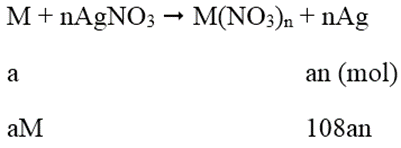
Khối lượng thanh thứ nhất tăng 151%:
108an - aM = 1,51 (1)
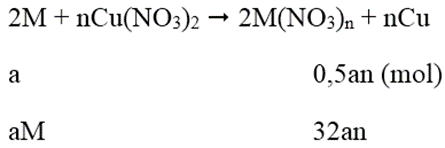
Khối lượng thanh thứ 2 giảm:
aM - 32an = 0,01 (2)
Tổ hợp (1) và (2) ta được: aM = 0,65; an = 0,02
⇒ Chon M = 32,5n
Khi n = 2 thì M = 65
Vậy M = Zn
Câu 10:
Cho 0,01 mol Fe vào 50ml dung dịch AgNO3 1M khi phản ứng kết thúc khối lượng Ag thu được là:
 Xem đáp án
Xem đáp án
Đáp án: B
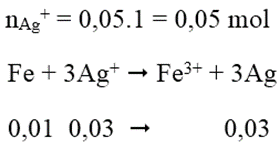
Câu 11:
Hòa tan 3 gam một hợp kim Cu-Ag trong dung dịch HNO3 tạo ra được 7,34 gam hỗn hợp gồm 2 muối Cu(NO3)2 và AgNO3. Vậy thành phần % của Cu và Ag trong hợp kim là:
 Xem đáp án
Xem đáp án
Đáp án: B
Sơ đồ chuyển hóa sau:
Cu → Cu(NO3)2
Ag → AgNO3
Ta lập được hệ gồm 2 phương trình:Giải ra được: x = 0,03, y = 0,01 → %Cu = 64%
Câu 12:
Ngâm một lá kẽm vào dung dịch chứa 2,24 gam ion kim loại M2+. Phản ứng xong, khối lượng lá Zn tăng thêm 0,94 gam. M2+ là ion kim loại nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án: D
Phản ứng:
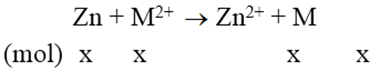
Vì khối lượng thanh kẽm tăng nên áp dụng phương trình đại số sau:
M.x – 65x = 0,94 (1)
Và
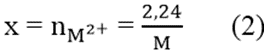
Từ (1) và (2)
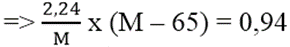
⇒ 2,24M – 145,6 = 0,94M ⇔ 1,3M = 145,6 ⇒ M = 112 : cađimin (Cd)
