Bài tập Phương pháp bảo toàn khối lượng cực hay có giải chi tiết (P1)
-
749 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Trộn 3,6g Al với 15,2g hỗn hợp oxit FeO và CuO rồi thực hiện phản ứng nhiệt nhôm thu được m g chất rắn. Tính giá trị của m.
 Xem đáp án
Xem đáp án
Khá nhiều bạn sẽ rập khuôn cách giải sau:
Ta có phản ứng:
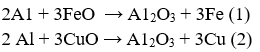
Đặt
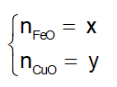
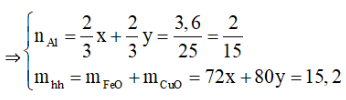
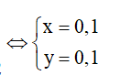
Từ (1) và (2) suy ra
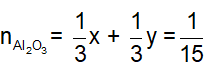
![]()
m = = 6,8 + 5,6 + 6,4 = 18,8 g
Đáp án A.
Câu 2:
Cho 23,4 gam hỗn hợp hai ancol đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng hết với 13,8 gam Na, thu được 36,75 gam chất rắn. Hai ancol đó là
 Xem đáp án
Xem đáp án
Đây là 1 bài toán khá quen thuộc, tuy nhiên không ít bạn khi gặp bài này đã mắc phải bẫy của người ra đề. Có phản ứng: 2ROH + 2Na ⇒ 2RONa + H2
Lỗi sai 1 : Ta có nNa = = 0,6 ⇒ nancol =0,6
⇒ 2 ancol là CH3OH và C2H5OH ⟹ Chọn đáp án sai là D
Lỗi sai 2: Áp dụng phương pháp tăng giảm khối lượng:
Khi 1 mol ROH phản ứng tạo ra 1 mol RONa thì khối lượng của hỗn hợp rắn sau phản ứng tăng lên (MNa - MH = 22 gam.)
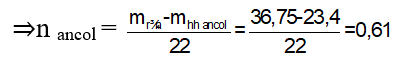
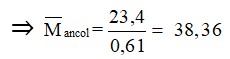
⇒ Chọn đáp án sai là D.
Cách giải đúng: Áp dụng định luật bảo toàn khối lượng, ta có:
=> = 23,4 + 13,8 - 36,75 = 0,45 g
⇒ nhỗn hợp ancol = = 2.0,225 = 0,45(mol)
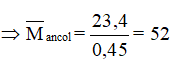
⟹ C2H5OH và C3H7OH
Câu 3:
Để trung hòa 25,6 gam hỗn hợp 2 axit cacboxylic đa chức cần dùng 1 lít dung dịch hỗn hợp NaOH 0,2M và Ba(OH)2 0,1M. Sau phản ứng cô cạn thu đuợc m gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Sơ đồ phản ứng:
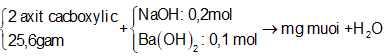
Có phản ứng tổng quát:
![]()
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
![]()
![]()
=> m = 25,6 + 0,2.40 + 0,1.171 - 0,4.18 = 43,5(gam)
Đáp án D.
Câu 4:
Nhiệt phân hoàn toàn A(NO3)2 (với R là kim loại) trong chân không thu được 9,6 gam một oxit kim loại và 6,048 lít hỗn hợp khí X gồm NO2 và O2 (đo ở đktc). Khối lượng của hỗn hợp khí X là 12 gam. Xác định công thức của muối A(NO3)2
 Xem đáp án
Xem đáp án
Đặt
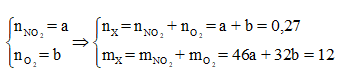
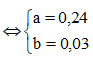
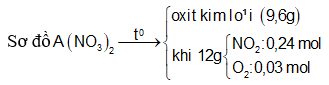
Cách 1: Áp dụng định luật bảo toàn khối lượng, không xét đến trong quá trình nhiệt phân A có thay đổi số oxi hóa hay không.Áp dụng định luật bảo toàn khối lượng ta có:
![]()
Bảo toàn nguyên tố N:
![]()
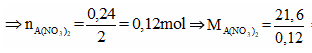
![]()
Vậy đáp án đúng là D.
Cách 2: Xét tỉ lệ mol giữa NO2 và O2 để tìm dạng phản ứng nhiệt phân của A(NO3)2 . Có
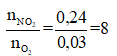
Khi đó trong quá trình nhiệt phân, A có sự thay đổi số oxi hóa từ +2 lên +3:
![]()
Quan sát 4 đáp án nhận thấy chỉ có Fe(NO3 )2 thỏa mãn.
Đáp án D.
Câu 5:
Nhiệt phân hoàn toàn m gam hỗn hợp X gồm CaCO3 và Na2CO3 thu được 11,6 gam chất rắn và 2,24 lít khí (đktc). Thành phần phần trăm khối lượng CaCO3 trong X là
 Xem đáp án
Xem đáp án
Na2CO3 không bị nhiệt phân, nên 2,24 lít khí sinh ra chính là CO2 do CaCO3 bị nhiệt phân theo phản ứng
![]()
Cách 1:
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
= 11,6 + 0,1.44 = 16 (gam)
Vậy phần trăm khối lượng của CaCO3 trong hỗn hợp X là:
![]()
Cách 2:
Ta có:
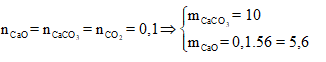
Hỗn hợp rắn thu được gồm CaO và Na2CO3
![]()
![]()
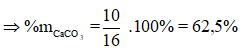
Đáp án D
Câu 6:
Cho 12 gam hỗn hợp hai kim loại Fe, Cu tác dụng vừa đủ với dung dịch HNO3 63%. Sau phản ứng thu được dung dịch A và 11,2 lít khí NO2 duy nhất (đktc). Tính nồng độ phần trăm của các chất có trong dung dịch A.
 Xem đáp án
Xem đáp án
Ta có thể viết 2 phản ứng:
Fe+6HNO3 ⇒ Fe(NO3)3 +3NO2 +3H2O
Cu+4HNO3 ⇒ Cu(NO3)2 +2NO2 +2H2O
Có
![]()
Quan sát các phản ứng nhận thấy:
![]()
![]()
Dung dịch A thu được chứa Fe(NO3)3 và Cu(NO3)2.
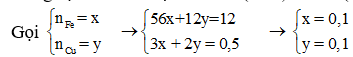
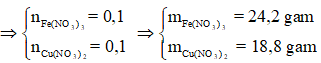
Áp dụng định luật bảo toàn khối lượng ta có:
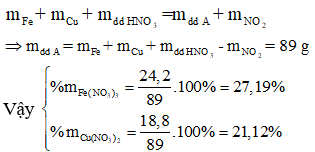
Đáp án B.
Câu 7:
Hỗn hợp X gồm Fe, FeO và Fe2O3. Cho một luồng CO đi qua ống sứ đựng m gam hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm thu được 64 gam chất rắn A trong ống sứ và 11,2 lít khí B (đktc) có tỉ khối so với H2 là 20,4. Tính giá trị m.
 Xem đáp án
Xem đáp án
Các phản ứng khử sắt oxit có thể có:
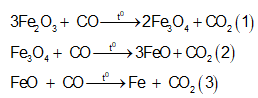
Như vậy chất rắn A có thể gồm 3 chất Fe, FeO, Fe3O4 Fe2O3 dư hoặc ít chất hơn, điều đó không quan trọng và việc cân bằng các phương trình trên cũng không cần thiết, các bạn chỉ cần quan sát và nhận thấy luôn có:
Ta có B gồm CO2 mới tạo thành và CO dư
Gọi:
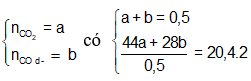
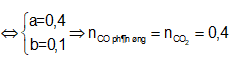
Áp dụng định luật bảo toàn khối lượng ta có:
![]()
⇒ m = 64 + 0,4.44 - 0,4.28 = 60,4 (gam)
Đáp án C.
Câu 8:
Hòa tan vừa hết hỗn hợp Q gồm 0,3 mol Fe3O4, 0,25 mol Fe và 0,2 mol CuO vào dung dịch hỗn hợp HCl 3M và HNO3 4M. Sau phản ứng hoàn toàn thu được dung dịch Y (chỉ chứa Fe3+ và Cu2+ và khí NO (là sản phẩm khử duy nhất). Tổng khối lượng muối trong dung dịch là
 Xem đáp án
Xem đáp án
Đây là 1 bài tập tổng hợp khá khó, đòi hỏi phải tính toán khá nhiều song hướng giải lại rất cụ thể và rõ ràng đó là ta sẽ sử dụng định luật bảo toàn khối lượng để tính khối lượng muối:
![]()
Do đó nhiệm vụ bây giờ là phải tìm được
![]()
+) Tính được khối lượng hỗn hợp Q dễ dàng:
![]()
+) Vì HCl và HNO3 trong cùng 1 dung dịch cho nên tỉ lệ về số mol cũng chính là tỉ lệ về nồng độ.
Gọi
⇒maxit = 3a.36,5 + 4a.63 = 361,5a (gam)
+) Sơ đồ bài toán:
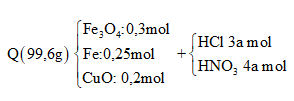
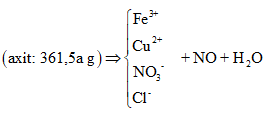
+) Ta lần lượt đi tìm các yếu tố còn thiếu:
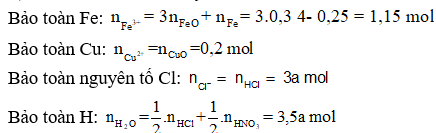
+) Áp dụng định luật bảo toàn điện tích ta có:
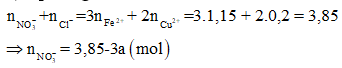
Tiếp tục sử dụng bảo toàn N:
![]()
![]()
Ta có:
![]()
= 315,9 - 79,5a (g)
Bây giờ ta cần phải tìm được a, nên nhớ là ta đã có các biểu diễn các yếu tố cần tìm theo a, do đó ta sử dụng định luật bảo toàn khối lượng:
hay 99,6 + 361,5a = 315,9 - 79,5a + 30.(7a - 3,85) +18.3,5a ⟺ a = 0,6
Vậy khối lượng muối trong dung dịch sau phản ứng là:
mmuối = 315,9 - 79,5.0,6 = 268,2 (gam)
Đáp án A.
Câu 9:
Đốt cháy hoàn toàn 1,88 gam chất hữu cơ A (chứa C, H, O) cần 1,904 lít O2 (đktc) thu được CO2 và hơi nước theo tỉ lệ thể tích 4:3. Hãy xác định công thức phân tử của A. Biết tỉ khối của A so với không khí nhỏ hơn 7.
 Xem đáp án
Xem đáp án
Thông thường khi đề bài cho số mol O2 cần để đốt cháy thì chắc chắn ta sẽ phải sử dụng hoặc định luật bảo khối lượng, hoặc bảo toàn nguyên tố Oxi.
Quay trở lại bài toán này, ta thấy đề cho cần dùng 1,904 lít O2, không cho khối lượng CO2 và H2O mà chỉ cho tỉ lệ thể tích (tỉ lệ số mol), do đó nhận ra được nếu ta sử dụng phương pháp bảo toàn khối lượng ta sẽ tính được số mol CO2 và số mol H2O, từ đó tính được số mol O trong A. Tiếp theo đó ta sẽ xác định công thức đơn giản nhất để tìm ra công thức phân tử.
Có:
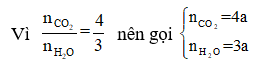
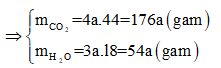
Sơ đồ phản ứng: A + O2 ⇒ CO2 + H2O
Áp dụng định luật bảo toàn khối lượng ta có:
Hay 1,88 + 2,72 = 176a + 54a ⟺ a = 0,02
⇒ 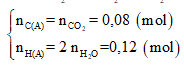
![]()
![]()
Vì C : H : O = nC : nH : nO =0,08 : 0,12 : 0,05 = 8 : 12 : 5
Nên công thức đơn giản nhất của A là C8H12O5.
Khi đó công thức phân tử của A có dạng (C8H12O5)n
Mà MA < 7Mkhôngkhí nên 188n < 7.29 ⇒ n < 1,08 ⇒ n = l
Do đó công thức phân tử của A là C8H12O5.
Đáp án A.
Câu 10:
Cho m gam bột Cu vào 200ml dung dịch AgNO3 0,2M, sau phản ứng thu được 3,88 gam chất rắn X và dung dịch Y. Cho 2,925 gam bột Zn vào dung dịch Y sau phản ứng thu được 5,265 gam chất rắn Z và dung dịch chỉ chứa 1 muối duy nhất. Giá trị của m là
 Xem đáp án
Xem đáp án
Thông thường, khi đọc xong đề bài các bạn sẽ viết các phản ứng:
Cu + 2AgNO3⟶Cu(NO3 )2 + 2Ag
Zn + Cu(NO3)2 ⟶ Zn(NO3)2 + Cu
Zn + 2AgNO3 ⟶ Zn(NO3)2 +2Ag.
Tuy nhiên phản ứng giữa Cu và AgNO3 ta không thể biết được chất nào dư, chất nào hết, do đó nếu làm theo cách bình thường ta sẽ thử xét 2 trường hợp, nhưng khi cho Zn vào dung dịch Y thì thì ta cũng không biết được chất nào dư, chất nào hết.
Do đó nếu nhìn theo cách bình thường thì bài toán trở nên rất phức tạp.
Tuy nhiên đọc lại đề bài 1 lần nữa, ta thấy có một giả thiết quan trọng là “dung dịch chỉ chứa 1 muối duy nhất”, đây chính là nút thắt của bài toán.
Dễ thấy dung dịch sau phản ứng chỉ chứa muối Zn(NO3)2
⇒ Tất cả ion sẽ đi hết vào muối Zn(NO3)2.
![]()
Khi ta không biết rõ chất nào dư hay hết, phản ứng đã xảy ra hoàn toàn hay chưa thì chúng ta nên nghĩ đến định luật bảo toàn khối lượng:
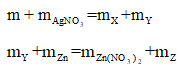
Cộng vế theo vế 2 phương trình trên ta được:
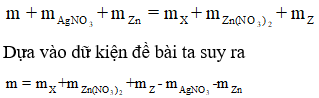
Hay m = 3,88 + 0,02.189 + 5,265 - 0,04.170 - 2,925 = 3,2 gam.
Đáp án D.
Câu 11:
Xà phòng hóa chất hữu cơ X đơn chức thu được muối Y và ancol Z. Đốt cháy hoàn toàn 4,8 gam Z cần 5,04 lít O2 (đktc) thu được CO2 và H2O mà khối lượng của chúng hơn kém nhau 1,2 gam. Nung muối Y với vôi tôi xút được khí T có tỉ khối so với H2 là 8. Vậy X là
 Xem đáp án
Xem đáp án
Quan sát 4 đáp án ta nhận thấy X là 1 este đơn chức.
Theo giả thiết: Nung muối Y với vôi tôi xút được khí T có tỉ khối so là 8 ⇒ T = 8.2 = 16 ⇒ T là CH4
Do đó muối Y là CH3COONa: CH3COONa + NaOH CH4 + Na2CO3
Suy ra X có dạng CH3COOR'.
Khi đó đáp án đúng là A hoặc C.
Giả thiết cho CO2 và H2O mà khối lượng của chúng hơn kém nhau 1,2 gam nên ta buộc phải xét 2 trường hợp:
Trường hợp 1:
Sơ đồ phản ứng:
A + NaOH muối Y + ancol Z
![]()
Ta đã có khối lượng Z và O2, , nên nhìn vào sơ đồ phản ứng ta thấy: nếu ta sử dụng định luật bảo toàn khối lượng thì ta sẽ có được tổng , từ đó giải hệ 2 ẩn tìm được ngay
Áp dụng định luật bảo toàn khối lượng, ta có:
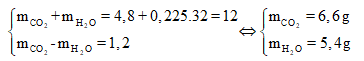
Từ đó suy ra:
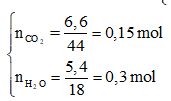
![]()
=> Z là ancol no đơn chức mạch hở
Với Z,
![]()
=> dựa vào 4 đáp án suy ra Z là
Hoặc sử dụng công thức áp dụng cho ancol no đơn chức mạch hở:
⇒ Trong Z có số C là: ⇒ Z là CH3OH
Kết hợp với X có dạng CH3COOR’
Vậy X là CH3COOCH3
Trường hợp 2
Cũng giải tương tự như trên, ta có ngay hệ
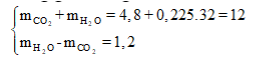
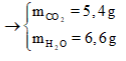
Suy ra:
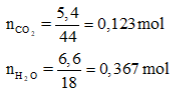
=> => Z là ancol no đơn chức mạch hở
Ta có: = 0,224
Trong Z có số C là:
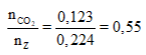
=> loại trường hợp này
Đáp án C
Câu 12:
Hỗn hợp khí X gồm 0,1 mol C2H2; 0,2 mol C2H4; 0,3 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 11. Hỗn hợp Y phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Áp dụng định luật bảo toàn khối lượng ta có:
mđầu = msau ⇒ nđầu.Mđầu = nsau.Msau
Ta có công thức rất quan trọng là
Vậy mục tiêu của ta bây giờ là đi tính n2.
Ta lần lượt có n1 = 0,1 + 0,2 + 0,3 = 0,6 mol.
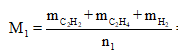
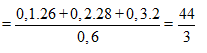
Mà M2 = 11. = 11.2 = 22 nên từ:
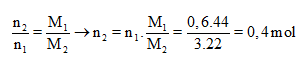
![]()
Phải hiểu rằng n2 = 0,2 mol nghĩa là số mol H2 đã phản ứng là 0,2 mol hay cũng chính là số mol π đã phản ứng là 0,2.
Do đó để tính a là số mol tối đa hỗn hợp Y phản ứng với Br2 trong dung dịch thì ta chỉ cần lấy số mol π ban đầu trừ đi số mol π ban đầu đã phản ứng, hay ta có
a = nπ (đầu) – nπ (đã phản ứng) = 0,1.2 + 0,2.1 –(0,6 – 0,4) = 0,2 mol
Đáp án B
Câu 13:
Hỗn hợp X gồm phenol và anilin. Lấy m gam X tác dụng vừa đủ với 200 ml dung dịch HCl 1M thu được hỗn hợp Y. Cho hỗn hợp Y tác dụng hết với 500 ml dung dịch NaOH 1M, rồi cô cạn thấy còn lại 31,3 gam chất rắn khan. Giá trị của m là:
 Xem đáp án
Xem đáp án
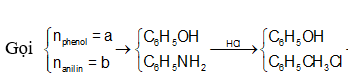
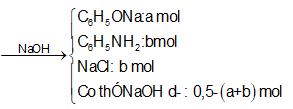
=> b =
![]()
![]()
Đáp án B
Câu 14:
Cho 28,2 gam hỗn hợp hai ancol đơn chức tác dụng hết với 11,5 gam Na, sau phản ứng thu 39,3 gam chất rắn. Nếu đun 28,2 gam hỗn hợp trên với H2SO4 đặc ở 140°C, thì thu được bao nhiêu gam ete
 Xem đáp án
Xem đáp án
Đáp án C
Có:
![]()
Vì hỗn hợp gồm 2 anncol đơn chức nên: .
Khi thực hiện phản ứng tách nước tạo ete thì:
Vậy
Câu 15:
Khối lượng tripeptit được tạo thành từ 178 gam alanin và 75 gam glyxin là:
 Xem đáp án
Xem đáp án
Đáp án C
Có: 3 mol amino axit ⟶ 1 mol tripeptit + 2 mol H2O
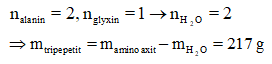
Câu 16:
Nhiệt phân hoàn toàn 80g một loại quặng đôlômit có lẫn tạp chất trơ, hòa tan chất rắn vào nước dư thấy còn lại 22,4 gam chất rắn không tan. Thành phần % khối lượng của tạp chất trong quặng nêu trên là:
 Xem đáp án
Xem đáp án
Đáp án A
Câu 17:
Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4. và Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp A bằng H2 dư thu được 42g chất rắn. Tính phần trăm khối lượng Cu trong hỗn hợp A:
 Xem đáp án
Xem đáp án
Đáp án A
Vì còn lại một phần chất rắn không tan nên Cu dư và trong dung dịch chứa FeCl2 và CuCl2
Có nO(A) = 0,5nHCl = 0,5
a = mkim loại + mO(A) = 42 + 16.0,5 = 50 (gam)
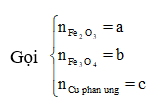
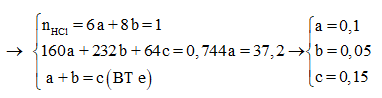
![]()
Câu 18:
Đung nóng m gam hỗn hợp X gồm các chất có cùng một loại nhóm chức với 600ml dung dịch NaOH 1,5M, thu được dung dịch Y chứa muối của một axit cacboxylic đơn chức và 15,4 gam hơi Z gồm các ancol. Cho toàn bộ Z tác dụng với Na dư, thu được 5,04 lít H2 (đktc). Cô cạn dung dịch Y đun nóng chất rắn thu được với CaO cho đến khi phản ứng xảy ra hoàn toàn, thu được 7,2 gam một chất khí. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
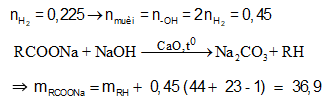
Theo định luật bảo toàn khối lượng ta có:
mX + mNaOH phản ứng = mmuối + mancol
⇒ m = 36,9 + 15,4 - 0,45.40 = 34,3 (gam)
Câu 19:
Anđêhit mạch hở A tác dụng với H2 theo tỷ lệ mol và tráng gương theo tỷ lệ mol . Đốt cháy hoàn toàn m gam A cần vừa đúng V lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào dung dịch nước vôi trong dư thu được a gam kết tủa. liên hệ giữa m với V và a là:
 Xem đáp án
Xem đáp án
Đáp án D
Theo giả thiết, có A là anđehit 2 chức no mạch hở có công thức phân từ tổng quát là CnH2n-2O2.
Phương trình đốt cháy:
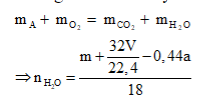
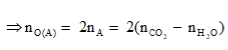
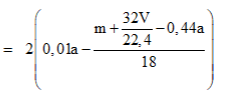
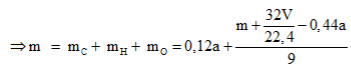
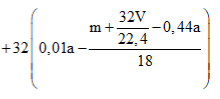
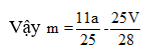
Câu 20:
X là tetra peptit Ala-Gly-Val-Ala, Y là tripeptit Val- Gly-Val. Đun nóng m gam hỗn hợp X và Y có tỷ lệ số mol nX : nY = 1:3 vói 780 ml dung dịch NaOH 1M (vừa đủ), sau phản ứng kết thúc thu được dung dịch Z. Cô cạn dung dịch thu được 94,98 gam muối. m có giá trị là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi số mol X và Y lần lượt là a và 3a.
Do đó
Theo định luật bảo toàn khối lượng có
mX + mY + mNaOH = mmuối +
Hay 316a+273.3a+0,78.40 = 94,98+18.4a
⇒ a = 0,06 ⇒ m = 68,1(gam)
Câu 21:
Hỗn hợp X gồm HCOOH và CH3COOH (tỉ lệ mol 1:1), hỗn hợp Y gồm CH3OH và C2H5OH (tỉ lệ mol 3:2). Lấy 11,13 gam hỗn hợp X tác dụng hết với 7,52 gam hỗn hợp Y có xúc tác H2SO4 đặc, đun nóng. Khối lượng của este thu được là (biết hiệu suất các phản ứng este đều 75%)
 Xem đáp án
Xem đáp án
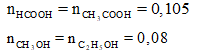
⇒ axit dư
Theo định luật bảo toàn khối lượng ta có:
Vậy meste = 0,075(46 + 60) + 0,09.32 + 0,06.46 - 0,15.18 = 10,89 (gam)
Đáp án B
Câu 22:
Cho 39,2 gam hỗn hợp M gồm Fe, FeO, Fe3O4, Fe2O3, CuO và Cu (trong đó oxi chiếm 18,367% về khối lượng) tác dụng vừa đủ với 850 ml dung dịch HNO3 nồng độ a mol/l, thu được 0,2 mol NO (sản phẩm khử duy nhất của N+5). Giá trị của a là
 Xem đáp án
Xem đáp án
Coi M gồm a mol Fe, b mol Cu và 0,45 mol O
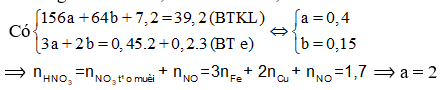
Đáp án A
Câu 23:
Hỗn hợp X gồm ankin Y và H2 có tỉ khối so với H2 là 6,7. Dẫn X đi qua bột Ni nung nóng cho đến khi các phản ứng xảy ra hoàn toàn thu được hỗn hợp Z có tỉ khối so với H2 là 16,75. Công thức phân tử của Y là
 Xem đáp án
Xem đáp án
, nên có 2 trường hợp có thể xảy ra (do phản ứng xảy ra hoàn toàn):
+ TH1: Nếu ankin dư, H2 hết thì ankin phải có khối lượng mol nhỏ hơn 33,5 và ankan tương ứng phải có khối lượng mol lớn hơn 33,5.
Khi đó không có ankin nào thỏa mãn
+ TH2: Nếu ankin hết và H2 dư thì hỗn hợp Z gồm H2 và ankan CnH2n+2. Chọn 1 mol hỗn hợp X ban đầu thì mX = mZ = 6,7.2 = 13,4 ⇒ nZ = 0,4
⇒ Z chứa 0,1 mol H2 nên 0,1.2+0,3(14n+2) = 13,4
Tìm được n = 3 khi đó ankin cần tìm là C3H4.
Đáp án C
Câu 24:
Có 500 ml dung dịch X chứa các ion: K+, HCO3-, Cl- và Ba2+. Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa. Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa. Mặt khác, nếu đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
 Xem đáp án
Xem đáp án
Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó:
Vậy khối lượng chất rắn khan thu được là:
Đáp án C
Câu 25:
Cho 2,16 gam axit cacboxylic đơn chức X tác dụng hoàn toàn với dung dịch chứa 0,02 mol KOH và 0,03 mol NaOH. Cô cạn dung dịch thu được sau khi phản ứng kết thúc còn lại 3,94 gam chất rắn khan. Công thức của X là
 Xem đáp án
Xem đáp án
Theo định luật bảo toàn khối lượng có:
maxit + mKOH + mNaOH = mrắn khan + ⇒ naxit = = 0,03
⇒ là CH2=CHCOOH
Đáp án B
Câu 26:
Cho m gam bột Fe vào 50 ml dung dịch Cu(NO3)2 1M, sau phản ứng thu được dung dịch X và 4,88 gam chất rắn Y. Cho 4,55 gam bột Zn vào dung dịch X, kết thúc phản ứng thu được 4,1 gam chất rắn Z và dung dịch chứa một muối duy nhất. Giá trị của m là
 Xem đáp án
Xem đáp án
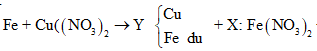
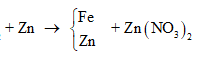
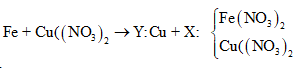
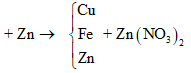
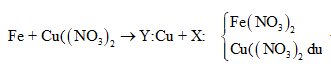
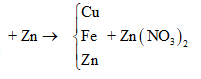
Theo định luật bảo toàn khối lượng, ta có:
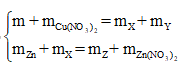
![]()
![]()
tìm được m = 4,48 (g)
Đáp án A
Câu 27:
Thực hiện phản ứng nhiệt nhôm (trong điều kiện không có không khí) hỗn hợp X gồm Al và Fe3O4 sau một thời gian thu được m gam hỗn hợp Y. Chia Y thành hai phần bằng nhau. Phần 1 tác dụng vừa đủ với 100 ml dung dịch NaOH 0,5M. Phần 2 tác dụng hết với dung dịch HNO3 đặc nóng, dư thu được 3,696 lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Giá trị của m là
 Xem đáp án
Xem đáp án
Coi hỗn hợp X ban đầu cũng như hỗn hợp Y gồm a mol Al và 3b mol Fe, 4b mol O.
Ở mỗi phần có nAl = 0,5a = nNaOH = 0,05 nên a = 0,1.
Áp dụng định luật bảo toàn mol electron cho phần 2 có:
hay 4,5b + 1,5a = 4b + 0,165 ⇒ b = 0,03.
Vậy m = mFe +mO + mAl = 9,66 (gam)
Đáp án C
Câu 28:
Cho 2,16 gam hỗn họp gồm Al và Mg tan hết trong dung dịch axit HNO3 loãng, đun nóng nhẹ tạo ra dung dịch X và 448 ml (đo ở 354,9°K và 988 mmHg) hỗn hợp khí Y khô gồm 2 khí không màu, không đổi màu trong không khí. Tỷ khối của Y so vói oxi bằng 0,716 lần tỷ khối của khí cacbonic so với nitơ. Làm khan X một cách cẩn thận thu được m gam chất rắn Z, nung Z đến khối lượng không đổi thu được 3,84 gam chất rắn T. Giá trị của m là
 Xem đáp án
Xem đáp án
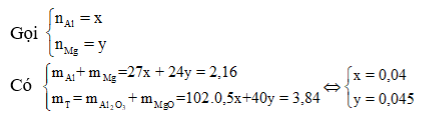
![]()
=> 2 khí đó là
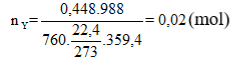
Áp dụng phương pháp đường chéo ta được:
= 0,01 mol
Ta thấy:
![]()
Suy ra phản ứng sinh muối :
![]()
Áp dụng định luật bảo toàn e, ta có:
![]()
= 213.0,04 + 148.0,045 +
Đáp án D
Câu 29:
Thực hiện tổng hợp tetrapeptit từ 3,0 mol glyxin; 4,0 mol alanin và 6,0 mol valin. Biết phản ứng xảy ra hoàn toàn. Khối lượng tetrapeptit thu được là
 Xem đáp án
Xem đáp án
Cứ 4 phân tử amino axit kết hợp với nhau để tạo ra tetrapeptit thì giải phóng ra 3 phân tử nước.
Do đó
Áp dụng định luật bảo toàn khối lượng:
Đáp án D
Câu 30:
Đun nóng m gam chất hữu cơ (X) chứa C, H, O với 100 ml dung dịch NaOH 2M đến khi phản ứng xảy ra hoàn toàn. Để trung hòa lượng NaOH dư cần 40 ml dung dịch HCl 1M. Làm bay hơi cẩn thận dung dịch sau khi trung hòa, thu được 7,36 gam hỗn hợp 2 ancol đơn chức (Y), (Z) và 15,14 gam hỗn hợp 2 muối khan, trong đó có một muối của axit cacboxylic (T). Kết luận nào sau đây đúng?
 Xem đáp án
Xem đáp án
Theo bài ra T là axit 2 chức. Gọi T là R(COOH)2.
X + dung dịch NaOH ⟶ R(COONa)2 + Y + Z.
Sau phản ứng NaOH dư 0,04 mol
⇒ số mol NaOH phản ứng với X là 0,2 - 0,04 = 0,16 mol.
Suy ra sau phản ứng ta có: 0,04 mol NaCl và 0,08 mol R(COONa)2. (bảo toàn nguyên tố Na).
Ta có: mmuối = mNaCl + mmuối T
⇒ 15,14 = 0,04.58,5 + 0,08. (R+72.2)
⇒ R = 26 (-CH = CH-)
Vậy X có dạng: R'OOC-CH = CH-COOR".
Áp dụng định luật bảo toàn khối lượng:
mX - mmuối T + mancol - mNaOH phản ứng
= 12,8 + 7,36 - 0,16.40 = 13,76(g)
⇒R’ + R” = 58 (C4H10)
⇒ R’ là CH3 - và R” là C3H7 -
A. Sai vì T có chứa 3 liên kết đôi trong phân tử
B. Đúng. Công thức phân tử của X là C8H12O4
C. Sai vì Y và Z chỉ cùng dãy đồng đẳng nhưng không liên tiếp nhau.
D. Sai vì X chỉ có 12 nguyên tử H.
Đáp án B
