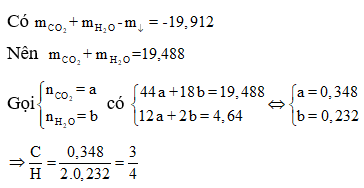Bài tập Phương pháp bảo toàn khối lượng cực hay có giải chi tiết (P2)
-
751 lượt thi
-
21 câu hỏi
-
21 phút
Danh sách câu hỏi
Câu 1:
Cho m gam butan qua xúc tác (ở nhiệt độ thích hợp), thu được hỗn hợp gồm 5 hiđrocacbon. Cho hỗn hợp khí này sục qua bình đựng dung dịch nước brom dư thì lượng brom tham gia phản ứng là 25,6 gam và sau thí nghiệm bình brom tăng 5,32 gam. Hỗn hợp khí còn lại sau khi qua dung dịch nước brom có tỉ khối so với metan là 1,9625. Giá trị của m là
 Xem đáp án
Xem đáp án
Phương trình phản ứng:
C4H10⟶ CH4 + C3H6
C4H10⟶C2H4+C2H6
Gọi x là số mol butan còn dư. Số mol khí thoát ra khỏi bình bằng số mol butan ban đầu.
Khi đó: khối lượng khí đi ra khỏi bình là:
m = mbutan ban đầu - mkhí bị hấp thụ = 58.(x +0,16) - 5,32.
⇒mbutan ban đầu = 58(l + x) = 11,6(g)
Đáp án D
Câu 2:
Tách nước hoàn toàn từ 25,8 gam hỗn hợp A gồm 2 ancol X và Y (MX < MY), sau phản ứng thu được hỗn hợp B gồm 2 anken kế tiếp nhau trong dãy đồng đẳng. Đốt cháy hoàn toàn B cần vừa đủ 1,8 mol O2. Mặt khác nếu tách nước không hoàn toàn 25,8 gam A (ở 140°C, xt H2SO4 đặc), sau phản ứng thu được 11,76 gam hỗn hợp các ete. Biết hiệu suất ete hóa của Y là 50%. Hiệu suất ete hóa của X là
 Xem đáp án
Xem đáp án
Gọi công thức phân tử trung bình của X và Y là:
![]()
Đốt cháy anken:
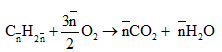
Ta có:
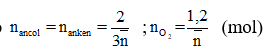
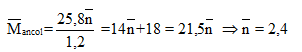
Vậy 2 ancol là:
![]()
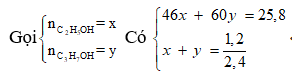
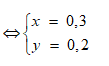
Gọi h là hiệu suất, luôn có:
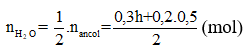
Áp dụng định luật bảo toàn khối lượng:
mancol phản ứng =
⇒ 46.0,3h + 60.0,1 = 11,76 +18.
⇒ h = 60%
Đáp án C
Câu 3:
Một hỗn hợp Y gồm 2 este A, B mạch hở (Ma< Mb). Nếu đun nóng 15,7 gam hỗn hợp Y với dung dịch NaOH dư thì thu được một muối của axit hữu cơ đơn chức và 7,6 gam hỗn hợp 2 ancol no đơn chức kế tiếp nhau trong dãy đồng đẳng. Nếu đốt cháy 15,7 gam hỗn hợp Y cần dùng vừa hết 21,84 lít O2 và thu được 17,92 lít CO2. Các thể tích khí đo ở đktc. Phần trăm khối lượng của A trong hỗn hợp Y là
 Xem đáp án
Xem đáp án
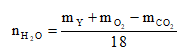
![]()
Áp dụng định luật bảo toàn nguyên tố O, ta có:
![]()
= 2.0,8 + 0,65 - 2.0,975 = 0,3
Gọi Y là RCOOR'(R' là gốc hidrocacbon trung bình)
Ta có:
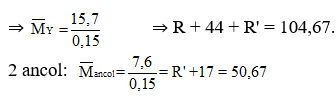
![]()
Suy ra 2 ancol là
![]()
Do đó, A là:
![]()
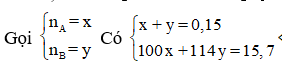
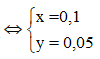
![]()
Đáp án A
Câu 4:
Trong chất béo luôn có một lượng axit béo tự do. Khi thủy phân hoàn toàn 2,145 kg chất béo cần dùng 0,3 kg NaOH, thu được 0,092 kg glixerol và m (kg) hỗn hợp muối natri. Giá trị của m là
 Xem đáp án
Xem đáp án
Phản ứng
![]()
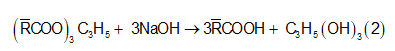
Trong đó là gốc hidrocacbon trung bình
Có:
![]()
![]()
Áp dụng định luật bảo toàn khối lượng:
=> m = 2,272 (kg)
Đáp án C
Câu 5:
Hỗn hợp X gồm 0,15 mol Mg và 0,1 mol Fe cho vào 500ml dung dịch Y gồm AgNO3 và Cu(NO3)2; sau khi phản ứng xong nhận được 20 gam chất rắn Z và dung dịch E; cho dung dịch NaOH dư vào dung dịch E, lọc kết tủa nung ngoài không khí nhận được 8,4 gam hỗn hợp 2 oxit. Nồng độ mol/l của AgNO3 và Cu(NO3)2 lần lượt là
 Xem đáp án
Xem đáp án
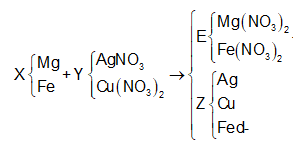
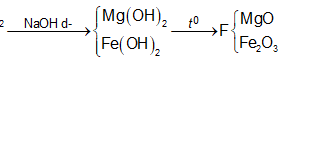
Trong F có 0,15 mol MgO và x mol Fe2O3 nên
0,1540 +x.160 = 8,4 ⇔ x = 0,015
nFe phản ứng = = 0,03
nFe dư = 0,1 – 0,03 = 0,07.
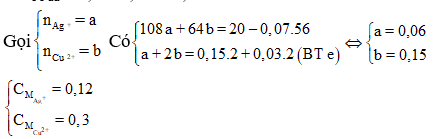
Đáp án C
Câu 6:
Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m và V lần lượt là
 Xem đáp án
Xem đáp án
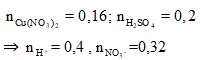
Vì thu được hỗn hợp bột kim loại nên Fe còn dư sau các phản ứng, trong dung dịch chứa Fe2+.
Coi các quá trình phản ứng xảy ra như sau:
3Fe + 8H+ + 2NO3- ⟶ 3Fe2+ + 2NO + 4H2O
Mol 0,15 0,4 0,1
Fe + Cu2+ ⟶ Fe2+ + Cu
Mol 0,16 0,16 0,16
⇒ 0,6m = m - 56(0,15 + 0,16) + 64.0,16
⇔ m = 17,8; V = 0,1.22,4 = 2,24 (lít)
Đáp án C
Câu 7:
Cho 3,6 gam axit cacboxylic no, đơn chức X tác dụng hoàn toàn vói 500 ml dung dịch gồm KOH 0,12M và NaOH 0,12M. Cô cạn dung dịch thu được 8,28 gam hỗn hợp chất rắn khan. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
nNaOH = 0,06; nKOH =0,06
Có RCOOH + MOH ⟶ RCOOM + H2O
Theo định luật bảo toàn khối lượng ta có:
mX +mNaOH + mKOH = mrắn khan +
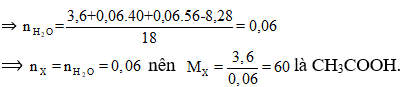
Đáp án D
Câu 8:
Cho hỗn hợp X gồm hai hợp chất hữu cơ no, đơn chức tác dụng vừa đủ với 100 ml dung dịch KOH 0,4M, thu được một muối và 336 ml hơi một ancol (ở đktc). Nếu đốt cháy hoàn toàn lượng hỗn hợp X trên, sau đó hấp thụ hết sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 (dư) thì khối lượng dung dịch trong bình giảm 2,66 gam. Công thức của hai hợp chất hữu cơ trong X là
 Xem đáp án
Xem đáp án
Theo giả thiết và 4 đáp án thì hỗn hợp X gồm 1 axit và 1 este có cùng gốc axit.
Có:
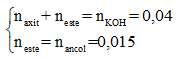
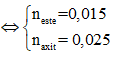
Gọi công thức phân tử của axit và este lần lượt là:
![]()
Khi đó đốt cháy X thu được:
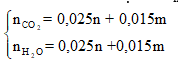
![]()
Do đó:
![]()
![]()
Nên:
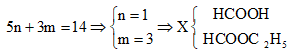
Đáp án A
Câu 9:
Cho 37,95g hỗn hợp hai muối MgCO3 và RCO3 vào 100ml dd H2SO4 loãng thấy có 1,12 lít CO2 (đktc) thoát ra, dung dịch A và chất rắn B. Cô cạn dung dịch A thu được 4g muối khan. Nung chất rắn B đến khối lượng không đổi thì thu được rắn B1 và 4,48 lít CO2 (đktc). Biết trong hỗn hợp đầu có tỉ lệ . Khối lượng chất rắn B1 và nguyên tố R là
 Xem đáp án
Xem đáp án
Tổng quát có:
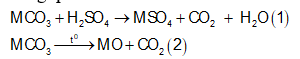
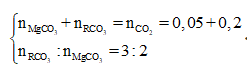
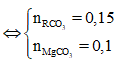
![]()
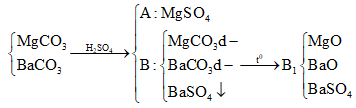
![]()
![]()
![]()
Đáp án D
Câu 10:
Cho hỗn hợp X gồm Fe3O4 và Fe2O3 vào dung dịch H2SO4 loãng dư thu được dung dịch X trong đó số mol Fe2(SO4)3 gấp 2 lần số mol FeSO4. Mặt khác, hòa tan hoàn toàn 39,2 gam hỗn hợp X trong H2SO4 đặc, nóng thu được bao nhiêu lít SO2 (đktc)?
 Xem đáp án
Xem đáp án
Quy đổi hỗn hợp X gồm a mol Fe2O3 và b mol FeO. Do đó
Theo giả thiết a = 2b ⇒hỗn hợp X gồm 2b mol Fe2O3 và b mol FeO.
Trong 39,2 gam hỗn hợp X gồm 2b’ mol Fe2O3 và b’ mol FeO ⟹ 320b'+72b' = 39,2
⟹ b’ = 0,1 ⟹ nFeO = 0,1
![]()
⟹ V = 1,12 (lít)
Đáp án C
Câu 11:
Este E được điều chế từ axit đơn chức, mạch hở X và ancol đơn chức, mạch hở Y. Đốt cháy hoàn toàn 4,8 gam E, thu được 5,376 lít CO2 và 3,456 gam H2O. Mặt khác, khi cho 15 gam E tác dụng vói 195 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thu được 14,1 gam chất rắn khan. Công thức cấu tạo của Y là
 Xem đáp án
Xem đáp án
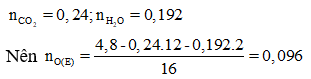
Vì X và Y đơn chức nên E là este đơn chức.
Suy ra E có 2 nguyên tử O trong phân tử.
Do đó nE = nO(E) =0,048
⇒ ME = = 100 là C5H8O2
Khi cho E tác dụng với dung dịch NaOH thì
nE =0,15; nNaOH =0,195⇒
Nên mmuối + mNaOH dư = 14,1 ⇔ mmuối = 12,3
⇒ Mmuối = = 82 là CH3COONa
Do đó Y là CH2=CHCH2OH.
Đáp án A
Câu 12:
Khi đun nóng 25,8 gam hỗn hợp ancol etylic và axit axetic có H2SO4 đặc làm xúc tác thu được 14,08 gam este. Nếu đốt cháy hoàn toàn lượng hỗn hợp đó thu được 23,4 ml H2O (lỏng). Tính thành phân trăm mỗi chất trong hỗn hợp đầu và hiệu suất của phản ứng este hoá.
 Xem đáp án
Xem đáp án
Gọi Đốt cháy sản phẩm cũng như hỗn hợp ban đầu, theo định luật bảo toàn nguyên tố H ta có:
Hay 6x + 4y = 2. = 2,6 (1)
Phương trình theo khối lượng: 46x + 60y = 25,8 (2)
Từ (1) và (2) suy ra: x = 0,3; y = 0,2
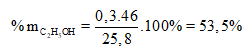
![]()
Theo lý thuyết
mà thực tế thu được 14,08 (g)
Vậy
Đáp án D
Câu 13:
Đốt cháy hoàn toàn 25,3 gam hỗn hợp X gồm RCOOH, C2H3COOH, và (COOH)2 thu được m gam H2O và 15,68 lít CO2 (đktc). Mặt khác, 25,3 gam hỗn hợp X phản ứng hoàn toàn với NaHCO3 dư thu được 11,2 lít (đktc) khí CO2 .Giá trị của m là:
 Xem đáp án
Xem đáp án
Mà mX = mC +mH +mO ⇒ mH =0,9 ⇒ ⇒m = 8,1(gam)
Đáp án A
Câu 14:
X là tetrapeptit Ala-Gly-Val-Ala, Y là tripeptit Val-Gly-Val. Đun nóng m gam hỗn hợp X và Y có tỉ lệ số mol nX : nY = 1 : 3 với 780 ml dung dịch NaOH 1M (vừa đủ), sau khi phản ứng kết thúc thu được dung dịch Z. Cô cạn dung dịch thu được 94,98 gam muối, m có giá trị là
 Xem đáp án
Xem đáp án
Gọi nX = a; nY =3x
có nNaOH = 4nX + 3nY = 13x = 0,78 ⇔ x = 0,06
⇒
Theo định luật bảo toàn khối lượng ta có:
m +
Đáp án C
Câu 15:
Đipeptit mạch hở X và tripeptit mạch hở Y đều được tạo nên từ một aminoaxit (no, mạch hở, trong phân tử chứa một nhóm -NH2 và một nhóm -COOH). Đốt cháy hoàn toàn 0,15 mol Y, thu được tổng khối lượng CO2 và H2O bằng 82,35 gam. Đốt cháy hoàn toàn 0,1 mol X, sản phẩm thu được cho lội từ từ qua nước vôi trong dư, tạo ra m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Gọi công thức phân tử của amino axit là CnH2n+1O2N thì công thức của Y là C3nH6n-1O4N3.
Đốt cháy hoàn toàn 0,15 mol Y thu được 0,45n mol CO2 và 0,15(3n-0,5) mol H2O
=> 44.0,45n + 18.0,15(3n-0,5) = 82,35
⇔ n = 3 nên amino axit là C3H7O2N.
Khi đó công thức phân tử của X là C6H12O3N2.
Đốt cháy hoàn toàn 0,1 mol X thu được 0,6 mol CO2
⇒ = 0,6 ⇒m = 60(gam).
Đáp án D
Câu 16:
Nung m gam hỗn hợp bột gồm Al và FexOy trong điều kiện không có không khí cho đến khi phản ứng hoàn toàn thu đươc hỗn hợp X. Trộn đều X, chia X thành 2 phân. Phần 1 (có khối lượng 14,49 gam) hòa tan hết trong HNO3 dư thu đươc 0,165 mol khí NO (sản phẩm khử duy nhất của N+5). Phần 2 tác dụng hết với dung dịch NaOH, t° thấy giải phóng 0,015 mol H2 và còn lại 2,52 gam chất rắn. Công thức sắt oxit và giá trị m là:
 Xem đáp án
Xem đáp án
Do phần 2 có H2 bay ra nên Al dư.
Hỗn hợp X gồm : x (mol) Al, y (mol) Fe, z (mol) Al2O3
- Xét phần 1: nAl = x1; nFe =y1
Bảo toàn e ta có: 3nNO = 3nFe + 3nAl ⇒ x1 + y1 = 0,165 (mol)
- Xét phần 2: Chất rắn là Fe.
Ta có nFe = y2 = 0,045 (mol)
nAl = y2 = = 0,01 mol ⇒ x2+y2=0,055mol
⇒ khối lượng phần 2 là 4,83 (g)
Vậy tổng khối lượng = 19,32 (g)
Xét phần 2 lại có: (g)(mol) ⟹ nO = 0,06 ⟹ ⟹ Fe3O4
Đáp án D
Câu 17:
Lấy V (ml) dung dịch H3PO4 35% (d = 1,25 g/ml) đem trộn với 200 ml dung dịch KOH 1M thu được dung dịch chứa 14,95 (g) muối. Giá trị V là:
 Xem đáp án
Xem đáp án
Đáp án B
Dung dịch chỉ chứa muối nên KOH và H3PO4 hết.
Ta thấy = 0,2 mol
Bảo toàn khối lượng ta có:
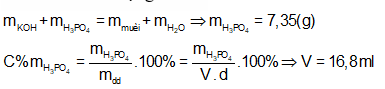
Câu 18:
Cho 2,76 (g) chất hữu cơ X chứa C, H, O tác dụng với dung dịch NaOH vừa đủ, sau đó chưng khô thì phần bay hơi chỉ có H2O, phần chất rắn khan còn lại chứa 2 muối của Na có khối lượng 4,44 (g). Đốt cháy hai muối này, trong oxi dư, sau khi phản ứng hoàn toàn, thu được 3,18 (g) Na2CO3 và 2,464 (l) CO2 (đktc) và 0,9 (g) H2O. Biết công thức đơn giản nhất cũng là công thức phân tử. Số công thức cấu tạo của X là:
 Xem đáp án
Xem đáp án
Phần bay hơi chỉ có nước, không có ancol đồng thời sản phẩm lại có 2 muối Na nên X là este của phenol, có thể có tạp chức.
![]()
Bảo toàn khối lượng, ta có:
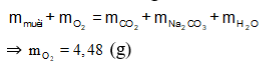
Bảo toàn nguyên tố O có:
![]()
Muối gồm 2 dạng: -ONa (x mol) à -COONa (y mol). Bảo toàn Na và O
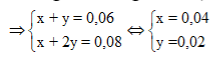
Do đó X phải là este đơn chức của phenol 2 chức. X có dạng R'-C6H3(OH)- OOCR
Có: nX = y = 0,02(mol) ⇒ nO trong X =0,06(mol)
Bảo toàn khối lượng: mX = mC + mO + mH
nH trong X = 0,12 ⇒ nC: nH: nO =7:6:3 ⟹ C7H6O3
Ta viết được 3 công thức cấu tạo thỏa mãn bài toán.
Đáp án C
Câu 19:
Để tác dụng hết với 100 gam lipit có chỉ số axit bằng 7 phải dùng 17,92 gam KOH. Khối lượng muối thu được sau phản ứng là:
 Xem đáp án
Xem đáp án
Số mol KOH để trung hòa axit là

Đáp án C
Câu 20:
Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200ml dung, dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
 Xem đáp án
Xem đáp án
; nNaOH =0,02; nKOH = 0,02 ⇒ nOH- =0,04
Vì nên OH- dư, muối thu được là CO32-
= 0,015
Vậy mrắn = .
Đáp án C