Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 3)
-
2063 lượt thi
-
19 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Trong số các nguyên tố halogen sau đây, nguyên tố nào có hàm lượng lớn nhất trong vỏ trái đất?
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Trong số các nguyên tố halogen, nguyên tố có hàm lượng lớn nhất trong vỏ trái đất là: Clo.
Câu 2:
Chất rắn X màu vàng, được dùng để sản xuất H2SO4. Chất X là
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Chất rắn X màu vàng, được dùng để sản xuất H2SO4. Chất X là S.
S + O2 SO2
2SO2 + O2 2SO3
SO3 + H2O → H2SO4
Câu 3:
Kim loại nào sau đây không tác dụng với H2SO4loãng?
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Kim loại không tác dụng với H2SO4loãng là: Cu.
Câu 4:
Cho phương trình hóa học: N2(k) + 3H2(k) 2NH3(k) ΔH < 0
Yếu tố nào sau đây không làm chuyển dịch cân bằng phản ứng trên?
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Cho phương trình hóa học:
N2(k) + 3H2(k) 2NH3(k) ΔH < 0
Yếu tố không làm chuyển dịch cân bằng phản ứng trên là: Chất xúc tác.
Câu 5:
Tốc độ phản ứng hóa học được xác định bằng độ biến thiên trong một đơn vị thời gian của đại lượng nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Tốc độ phản ứng được xác định bằng độ biến thiên nồng độ của chất trong đơn vị thời gian.
Câu 6:
Sục khí SO2từ từ đến dư vào nước brom (màu vàng), thấy
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Sục khí SO2từ từ đến dư vào nước brom (màu vàng), thấy nước brom bị mất màu.
SO2+ Br2+ 2H2O → 2HBr + H2SO4
Câu 7:
Thí nghiệm điều chế khí Z được mô tả ở hình bên.
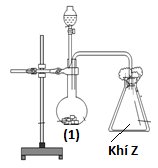 Phản ứng hóa học xảy ra trong bình (1) có thể là
Phản ứng hóa học xảy ra trong bình (1) có thể là
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Phản ứng hóa học xảy ra trong bình (1) là:
Na2SO3+ H2SO4Na2SO4+ SO2+ H2O.
Câu 8:
Hòa tan hoàn toàn 11,2 gam bột Fe vào dung dịch HCl dư, thấy thoát ra V lít khí H2(đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Số mol Fe là: nFe= = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,2 mol
Vậy = 0,2.22,4 = 4,48 lít
Câu 9:
Axit clohiđric thể hiện tính khử trong phản ứng nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Axit clohiđric thể hiện tính khử trong phản ứng:
4HCl + MnO2 MnCl2+ Cl2+ 2H2O.
Trong phản ứng này số oxi hóa của Cl tăng từ -1 lên 0, do đó HCl thể hiện tính khử.
Câu 10:
Ở điều kiện thường, brom tồn tại ở trạng thái
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Brom là một chất lỏng bốc khói màu nâu đỏ ở nhiệt độ phòng.
Câu 11:
Cho sơ đồ chuyển hóa sau:
Biết X, Y, Z là các hợp chất vô cơ của lưu huỳnh. Cho các phát biểu sau:
(a) Z có tên là axit sunfurơ.(b) Z có tính khử mạnh
(c) Y tan nhiều trong nước. (d) X có mùi trứng thối.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng: B
S + H2H2S (X)
H2S + O2SO2(Y) + H2O
SO2+ Br2+ 2H2O → H2SO4(Z) + 2HBr
Phát biểu đúng là
(c) Y tan nhiều trong nước.
(d) X có mùi trứng thối.
Phát biểu a sai vì X là axit sunfuric
Phát biểu b sai vì Z có tính oxi hóa mạnh.
Câu 12:
Cho các cặp chất sau tác dụng với nhau:
(a) HCl đặc và KMnO4.(b) SiO2và HF.
(c) NaBr và AgNO3.(d) Al và I2.
Số cặp chất xảy ra phản ứng oxi hóa - khử là
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Phản ứng oxi hóa - khử là
(a) 16HClđặc+ 2KMnO4→ 2KCl + 2MnCl2+ 5Cl2+ 8H2O
(d) 2Al + 3I22AlI3
Câu 13:
Cho các phát biểu sau:
(a) Người ta xông đũa và quả nhãn bằng bột lưu huỳnh để lợi dụng tính tẩy trắng, chống nấm mốc của nó.
(b) Có thể ngâm rau trong dung dịch NaCl loãng để khử trùng do dung dịch NaCl có tính oxi hóa mạnh.
(c) Người ta thêm một lượng nhỏ I2vào muối ăn để sản xuất muối iot.
(d) Nên bảo quản nước Gia-ven trong bình bằng nhựa trong suốt, đặt dưới ánh sáng mặt trời để tăng hoạt tính oxi hóa của nó.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Phát biểu đúng là:
(a) Người ta xông đũa và quả nhãn bằng bột lưu huỳnh để lợi dụng tính tẩy trắng, chống nấm mốc của nó.
Câu 14:
Hiện nay, axit sunfuric được tổng hợp từ lưu huỳnh theo phương pháp tiếp xúc kép qua ba giai đoạn với hiệu suất của toàn bộ quá trình đạt 88%. Theo quá trình trên, từ 1,00 tấn lưu huỳnh có thể sản xuất được bao nhiêu tấn dung dịch H2SO498%?
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Ta có sơ đồ:
S H2SO4
1,0 tấn → 1,0. = 2,695 tấn
Suy ra thu được là: 2,695 tấn
Vậy = 2,75 tấn.
Câu 15:
Cho 2,06 gam muối NaX tác dụng với dung dịch AgNO3dư. Toàn bộ kết tủa sinh ra được phân hủy hoàn toàn, thu được 2,16 gam bạc. Muối NaX là
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Số mol Ag là: nAg= 0,02 mol
Phương trình phản ứng:
Suy ra 0,02 = Suy ra X = 80
Suy ra X là Br
Vậy muối NaX là NaBr.
Câu 16:
Viết phương trình hóa học xảy ra (nếu có) giữa các cặp chất sau. Nếu không xảy ra phản ứng thì đánh dấu chéo lên dấu mũi tên.
a. S + O2
b. Cl2 + NaBr
c. Br2 + SO2 + H2O
d. HCl + Na2SO4
 Xem đáp án
Xem đáp án
a. S + O2SO2
b. Cl2+ 2NaBr 2NaCl + Br2
c. Br2+ SO2+ 2H2O H2SO4+ 2HBr
d. HCl + Na2SO4Không phản ứng.
Câu 17:
Có 4 ống nghiệm được đánh số từ (1) đến (4), chứa 4 dung dịch của các chất (không theo thứ tự) là HCl, H2SO4, NaCl và NaOH. Một học sinh đã trích mẫu thử và tiến hành các thí nghiệm với kết quả như sau:
|
|
Mẫu thử trích ra từ các ống nghiệm |
|||
|
Thuốc thử |
(1) |
(2) |
(3) |
(4) |
|
Quỳ tím |
Hóa đỏ |
Hóa xanh |
Không đổi màu |
Hóa đỏ |
|
Dung dịch BaCl2 |
? |
Không hiện tượng |
?? |
Không hiện tượng |
a. Các ống nghiệm (1), (2), (3), (4) lần lượt chứa những dung dịch nào?
b. Hiện tượng gì xảy ra ở ô được đánh dấu (?) và (??) trong bảng trên?
 Xem đáp án
Xem đáp án
a. (1) là H2SO4; (2) là NaOH ; (3) là NaCl; (4) là HCl
b. Ống 1 (ô có dấu ?): Xuất hiện kết tủa màu trắng của BaSO4
Ống 3 (ô có dấu ??): Không hiện tượng.
Câu 18:
Hỗn hợp X gồm Cu và CuO. Biết rằng 20 gam X phản ứng vừa đủ với 100 ml dung dịch H2SO4 1M (loãng). Xác định phần trăm khối lượng mỗi chất trong X.
 Xem đáp án
Xem đáp án
Số mol H2SO4= 0,1.1 = 0,1mol
Phương trình hóa học:
Theo phương trình phản ứng suy ra nCuO= 0,1mol
Suy ra mCuO= 0,1.80 = 8gam
Vậy %mCuO= = 40%
%mCu= 100% - 40% = 60%
Câu 19:
Có 20,16 gam bột sắt, sau một thời gian bị oxi hóa không hoàn toàn bởi oxi không khí, tạo thành 25,28 gam hỗn hợp X gồm Fe, FeO, Fe2O3và Fe3O4. Tính thể tích khí SO2(sản phẩm khử duy nhất, điều kiện tiêu chuẩn) tối đa thu được khi cho toàn bộ lượng hỗn hợp X trên phản ứng với dung dịch H2SO4đặc, nóng, dư.
 Xem đáp án
Xem đáp án
Ta có: nFe= = 0,36 mol,
nO(oxit)= = 0,32 mol
Ta có các quá trình:
Áp dụng định luật bảo toàn e
= = 0,22 mol
= 0,22.22,4 = 4,928 lít
