Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 4)
-
2062 lượt thi
-
19 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Axit nào sau đây có trong dịch vị dạ dày, giúp tiêu hóa thức ăn?
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Axit có trong dịch vị dạ dày, giúp tiêu hóa thức ănHCl.
Câu 2:
Lưu huỳnh đioxit là một trong những tác nhân chính gây ra hiện tượng mưa axit. Công thức hóa học của lưu huỳnh đioxit là
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
Lưu huỳnh đioxit là một trong những tác nhân chính gây ra hiện tượng mưa axit. Công thức hóa học của lưu huỳnh đioxit là SO2.
Câu 3:
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 đặc, nguội?
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Kim loại không tác dụng với dung dịch H2SO4 đặc, nguội Fe.
Câu 4:
Cho phương trình hóa học: 2SO2(k) + O2(k) 2SO3(k) ΔH < 0
Yếu tố nào sau đây không làm ảnh hưởng đến sự chuyển dịch cân bằng phản ứng trên?
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Yếu tố không làm ảnh hưởng đến sự chuyển dịch cân bằng phản ứng trên là: Chất xúc tác.
Câu 5:
Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Yếu tố không ảnh hưởng đến tốc độ phản ứng là: Thể tích của hệ.
Câu 6:
Sục khí SO2từ từ đến dư vào dung dịch axit H2S, thấy
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
Sục khí SO2 từ từ đến dư vào dung dịch axit H2S, thấy có kết tủa vàng.
SO2+ 2H2S → 3S \( \downarrow \)+ 2H2O
Câu 7:
Thí nghiệm điều chế khí Z được mô tả ở hình bên.
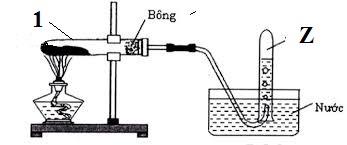
Phản ứng hóa học xảy ra trong ống nghiệm (1) có thể là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Theo hình vẽ thấy đây là phản ứng nhiệt phân → Loại C, D.
Phản ứng hóa học xảy ra trong ống nghiệm (1) có thể là
2KClO3 2KCl + 3O2.
Loại A do điều kiện của phản ứng A diễn ra ở khoảng 1500oC.
Câu 8:
Hòa tan hoàn toàn 7,2 gam bột Mg vào dung dịch HCl dư, thấy thoát ra V lít khí H2(đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Số mol Mg là: nMg= \(\frac{{7,2}}{{24}}\) = 0,3 mol
Phương trình phản ứng: \[\]
\(\begin{array}{l}Mg + 2HCl \to MgC{l_2} + {H_2}\\0,3{\rm{ 0,3 mol}}\end{array}\)
Vậy \({V_{{H_2}}}\)= 0,3.22,4 = 6,72 lít.
Câu 9:
Dãy nào sau đây gồm các chất đều tác dụng được với dung dịch HCl?
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
CaCO3+ 2HCl → CaCl2+ CO2+ H2O
AgNO3+ HCl → AgCl↓ + HNO3
CuO + 2HCl → CuCl2+ H2O
Câu 10:
Ở điều kiện thường, iot tồn tại ở trạng thái
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Ở điều kiện thường, iot tồn tại ở trạng thái rắn.
Câu 11:
Cho sơ đồ chuyển hóa sau:
Biết X, Y, Z là các hợp chất vô cơ của lưu huỳnh. Cho các phát biểu sau:
(a) Z có tên là axit sunfurơ.
(b) Z có tính axit mạnh.
(c) Z tan vô hạn trong nước.
(d) X có mùi trứng thối.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
S + H2H2S
H2S + \(\frac{3}{2}\)O2SO2+ H2O
SO2+ Br2+ 2H2O → H2SO4+ 2HBr
Số phát biểu đúng là
(b) Z có tính axit mạnh
(c) Z tan vô hạn trong nước
(d) X có mùi trứng thối.
Câu 12:
Cho cặp chất sau tác dụng với nhau:
(a) HCl đặc và KMnO4.
(b) SiO2 và HF.
(c) Br2 và NaI. (d) Al và I2.
Số cặp chất xảy ra phản ứng oxi hóa - khử là
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
(a) 16HCl đặc+2KMnO4→ 2KCl + 2MnCl2+ 5Cl2+ 8H2O
(c) Br2+ 2NaI → I2+ 2NaBr
(d) 2Al +3I22AlI3
Câu 13:
Cho các phát biểu sau:
(a) Người ta xông đũa và quả nhãn bằng bột lưu huỳnh để lợi dụng tính tẩy trắng, chống nấm mốc của SO2.
(b) Có thể ngâm rau trong dung dịch NaCl loãng để khử trùng do dung dịch NaCl có tính oxi hóa mạnh.
(c) Người ta thêm một lượng nhỏ I2vào muối ăn để sản xuất muối iot.
(d) Nên bảo quản nước Gia-ven trong bình bằng nhựa trong suốt, đặt dưới ánh sáng mặt trời để tăng hoạt tính oxi hóa của nó.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Phát biểu đúng là: (a)
Câu 14:
Hiện nay, axit sunfuric được tổng hợp từ lưu huỳnh theo phương pháp tiếp xúc kép qua ba giai đoạn với hiệu suất của toàn bộ quá trình đạt 88%. Theo quá trình trên, từ 2,00 tấn lưu huỳnh có thể sản xuất được bao nhiêu tấn dung dịch H2SO498%?
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Ta có sơ đồ:
S H2SO4
2,0 tấn → \(2.\frac{{98}}{{32}}.\frac{{88}}{{100}}\) = 5,39 tấn
Suy ra \({m_{{H_2}S{O_4}}}\)thu được là: 5,39 tấn
Vậy \({m_{{\rm{dd}}{H_2}S{O_4}(98\% )}} = \frac{{5,39}}{{98}}.100\) = 5,5 tấn.\[\]
Câu 15:
Cho 2,34 gam muối NaX tác dụng với dung dịch AgNO3dư. Toàn bộ kết tủa sinh ra được phân hủy hoàn toàn, thu được 4,32 gam bạc. Muối NaX là
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Số mol Ag là: nAg= 0,04 mol
Phương trình phản ứng:
\[\begin{array}{l}NaX{\rm{ }} + {\rm{ }}AgN{O_3} \to {\rm{ }}NaN{O_3} + {\rm{ }}AgX\\\frac{{2,34}}{{23 + X}}{\rm{ }}\frac{{2,34}}{{23 + X}}{\rm{ mol}}\end{array}\]
\[\begin{array}{l}2AgX{\rm{ }} \to {\rm{ }}{X_2} + {\rm{ }}2Ag\\0,04{\rm{ 0,04 mol}}\end{array}\]
Suy ra 0,04 = \[\frac{{2,34}}{{23 + X}}\] Suy ra X = 35,5
Suy ra X là Clo
Vậy muối NaX là NaCl.
Câu 16:
Viết phương trình hóa học xảy ra (nếu có) giữa các cặp chất sau. Nếu không xảy ra phản ứng thì đánh dấu chéo lên dấu mũi tên.
a. NaCl + H2O ![]()
b. Cl2 + H2
c. HCl + Cu
d. CuCl2 + NaOH
 Xem đáp án
Xem đáp án
a. 2NaCl + 2H2O ![]() 2NaOH + Cl2+ H2
2NaOH + Cl2+ H2
b. Cl2+ H22HCl
c. HCl + Cu Không xảy ra
d. CuCl2+ 2NaOH → Cu(OH)2↓ + 2NaCl
Câu 17:
Có 4 ống nghiệm được đánh số từ (1) đến (4), chứa 4 dung dịch của các chất (không theo thứ tự) là NaCl, K2SO4, HCl và KOH. Một học sinh đã trích mẫu thử và tiến hành các thí nghiệm với kết quả như sau:
|
|
Mẫu thử trích ra từ các ống nghiệm |
||||
|
Thuốc thử |
(1) |
(2) |
(3) |
(4) |
|
|
Quỳ tím |
Hóa xanh |
Không đổi màu |
Không đổi màu |
Hóa đỏ |
|
|
Dung dịch BaCl2 |
?? |
Không hiện tượng |
? |
Không hiện tượng |
a. Các ống nghiệm (1), (2), (3), (4) lần lượt chứa những dung dịch nào?
b. Hiện tượng gì xảy ra ở ô được đánh dấu (?) và (??) trong bảng trên?
 Xem đáp án
Xem đáp án
a. Ống 1: KOH; Ống 2: NaCl; Ống 3: K2SO4; Ống 4: HCl.
b. Ống 1 (ô có dấu ??): Không hiện tượng
Ống 3 (ô có dấu ?): Kết tủa màu trắng
K2SO4+ BaCl2→ 2KCl + BaSO4↓
Câu 18:
Hỗn hợp X gồm Cu và CuO. Biết rằng 32 gam X phản ứng vừa đủ với 200 ml dung dịch H2SO41M (loãng). Xác định phần trăm khối lượng mỗi chất trong X.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
Số mol H2SO4là: \[{n_{{H_2}S{O_4}}}\]= 0,2.1 = 0,2 mol
Phương trình phản ứng:
\[\begin{array}{*{20}{l}}{\;CuO{\rm{ }} + {\rm{ }}{H_2}S{O_4}\; \to {\rm{ }}CuS{O_4}\; + {\rm{ }}{H_2}O\;}\\{\;0,2\;\;\;\;\;\;\;\;{\rm{ }}0,2{\rm{ mol}}}\end{array}\]
Số mol CuO là: nCuO= 0,2 mol
Suy ra mCuO= 0,2.80 = 16gam
Vậy % mCuO= \[\frac{{16}}{{32}}.100\% \]= 50%
%mCu= 100% - 50% = 50%
Câu 19:
Có 40,32 gam bột sắt, sau một thời gian bị oxi hóa không hoàn toàn bởi oxi không khí, tạo thành 50,56 gam hỗn hợp X gồm Fe, FeO, Fe2O3và Fe3O4. Tính thể tích khí SO2(sản phẩm khử duy nhất, điều kiện tiêu chuẩn) tối đa thu được khi cho toàn bộ lượng hỗn hợp X trên phản ứng với dung dịch H2SO4 đặc, nóng, dư.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
Ta có: nFe= \[\frac{{40,32}}{{56}}\]= 0,72 mol;
nO= \[\frac{{50,56 - 40,32}}{{16}}\]= 0,64 mol
Ta có:
\[\begin{array}{*{20}{l}}\begin{array}{l}\mathop {Fe}\limits^0 {\rm{ }} \to {\rm{ }}\mathop {Fe}\limits^{ + 3} \; + 3e\\0,72\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,2,16\,\,\,\,\,\,\,\,\,\,\,mol\end{array}\\\begin{array}{l}\mathop O\limits^0 \,\,\,\, + {\rm{ }}2e{\rm{ }} \to \mathop O\limits^{ - 2} \;\;\\0,64\,\,\,\,\,\,1,28\;\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,mol\;\;\;\;\;\;\;\end{array}\\\begin{array}{l}\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \\x\,\,\,\,\,\,2x\,\,\,\,\,\,\,\,\,\,mol\end{array}\end{array}\]
Áp dụng định luật bảo toàn e
\[{n_{S{O_2}}} = \frac{{2,16 - 1,28}}{2}\] = 0,44 (mol)
Vậy \[{V_{S{O_2}}}\]= 0,44 .22,4 = 9,856(lít)
