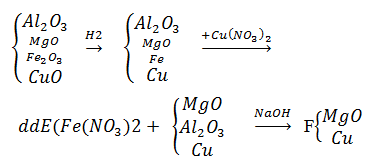Trắc nghiệm Luyện tập điều chế kim loại và sự ăn mòn kim loại có đáp án (Vận dụng)
-
832 lượt thi
-
10 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Tiến hành các thí nghiệm sau:
(a) Nhúng thanh đồng nguyên chất vào dung dịch FeCl3.
(b) Cắt miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm.
(c) Nhúng thanh kẽm vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4.
(d) Quấn sợi dây đồng vào đinh sắt rồi nhúng vào cốc đựng dung dịch NaCl.
Trong các thí nghiệm trên, số thí nghiệm chỉ xảy ra ăn mòn điện hóa học là
 Xem đáp án
Xem đáp án
(a) chỉ xảy ra ăn mòn hóa học
(b) xảy ra cả ăn mòn hóa học và ăn mòn điện hóa học
(c) xảy ra ăn mòn hóa học và điện hóa học
(d) Chỉ xảy ra ăn mòn điện hóa học
Vậy chỉ có 1 thí nghiệm (d) xảy ra ăn mòn điện hóa học
Câu 2:
Tiến hành 6 thí nghiệm sau đây
TN1: Nhúng thanh sắt vào dung dịch FeCl3.
TN2: Nhúng thanh sắt vào dung dịch CuSO4.
TN3: Để chiếc đinh làm bằng thép ngoài không khí ẩm.
TN4: Cho chiếc đinh làm bằng sắt vào dung dịch H2SO4.
TN5: Nhúng thanh đồng vào dung dịch Fe2(SO4)3.
TN6: Nhúng thanh nhôm vào dung dịch H2SO4 loãng có hòa tan vài giọt CuSO4.
Số trường hợp xảy ra ăn mòn điện hóa là
 Xem đáp án
Xem đáp án
(1) Fe + 2FeCl3 → 3FeCl2 không tạo ra 2 điện cực mới → ăn mòn hóa học
(2) Fe + CuSO4 → FeSO4 + Cu
→ Cu sinh ra bám vào thanh sắt và hình thành 2 điện cực cùng tiếp xúc với dung dịch chất điện li
→ xảy ra ăn mòn điện hóa
(3) Đinh thép là hợp kim Fe-C, để ngoài không khí ẩm xảy ra sự ăn mòn điện hóa
(4) Fe + H2SO4 → FeSO4 + H2
không tạo ra 2 điện cực mới → ăn mòn hóa học
(5) Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
không tạo ra 2 điện cực mới → ăn mòn hóa học
(6) 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
→ Cu sinh ra bám vào thanh nhôm và hình thành 2 điện cực cùng tiếp xúc với dung dịch chất điện li
→ xảy ra ăn mòn điện hóa
Vậy có 3 trường hợp xảy ra ăn mòn điện hóa
Câu 3:
Tiến hành các thí nghiệm sau :
(1) Nhúng thanh Zn vào dung dịch AgNO3.
(2) Cho vật bằng gang vào dung dịch HCl.
(3) Cho Na vào dung dịch CuSO4.
(4) Để miếng tôn (Fe tráng Zn) có vết xước sâu ngoài không khí ẩm.
(5) Cho đinh sắt vào dung dịch H2SO4 2M.
(6) Cho Mg vào dung dịch FeCl3 dư.
Số thí nghiệm xảy ra ăn mòn hóa học là
 Xem đáp án
Xem đáp án
(1) Zn + AgNO3 → Zn(NO3)2 + Ag
=> ăn mòn điện hóa
(2) Gang có thành phần chính là Fe và C
Fe + 2HCl → FeCl2 + H2
Tạo ra 2 điện cực mới (Fe là cực (-), C là cực (+) → ăn mòn điện hóa
(3) Cho Na vào dung dich CuSO4 có phản ứng
2Na + 2H2O → 2NaOH + H2
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
Phản ứng không tạo ra 2 điện cực mới → ăn mòn hóa học
(4) Tôn là Fe gắn với Zn. Vết xước sâu để cả Fe và Zn đều tiếp xúc với môi trường không khí ẩm
→ xảy ra ăn mòn điện hóa
(5) Fe + H2SO4 → FeSO4 + H2 không tạo ra 2 điện cực mới → ăn mòn hóa học
(6) Mg + FeCl3 dư → MgCl2 + FeCl2 không tạo ra 2 điện cực mới → ăn mòn hóa học
Câu 4:
Thực hiện các thí nghiệm sau :
(1) Thả một viên Fe vào dung dịch Cu(NO3)2.
(2) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng.
(3) Thả một viên Fe vào dung dịch FeCl3.
(4) Nối một dây Sn với một dây Fe rồi để trong không khí ẩm.
(5) Thả một viên Fe vào dung dịch HCl.
Trong các thí nghiệm trên thì thí nghiệm mà Fe bị ăn mòn điện hóa học là
 Xem đáp án
Xem đáp án
(1) Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
→ Cu sinh ra bám vào viên Fe và hình thành 2 điện cực cùng tiếp xúc với dung dịch chất điện li
→ xảy ra ăn mòn điện hóa
(2) Fe + CuSO4 + H2SO4: cả ăn mòn điện hóa và ăn mòn hóa học vì xảy ra các phản ứng sau
Fe + H2SO4 → FeSO4 + H2 (ăn mòn hóa học vì không hình thành 2 điện cực mới)
Fe + CuSO4 → FeSO4 + Cu
→ Cu sinh ra bám vào thanh sắt và hình thành 2 điện cực cùng tiếp xúc với dung dịch chất điện li
→ xảy ra ăn mòn điện hóa
(3) Fe + 2FeCl3 → 3FeCl2 không tạo thành 2 điện cực mới → ăn mòn hóa học
(4) Sn và Fe được nối với nhau và đặt trong không khí ẩm → ăn mòn điện hóa
(5) Fe + 2HCl → FeCl2 + H2 không tạo ra 2 điện cực mới → ăn mòn hóa học
Câu 6:
Tiến hành các thí nghiệm sau:
(1) Cho Mg vào dung dịch Fe2(SO4)3 dư;
(2) Dẫn khí H2 (dư) qua bột MgO nung nóng;
(3) Cho dung dịch AgNO3 tác dụng với dung dịch Fe(NO3)2 dư;
(4) Cho Na vào dung dịch MgSO4;
(5) Nhiệt phân Hg(NO3)2;
(6) Đốt Ag2S trong không khí;
(7) Điện phân dung dịch Cu(NO3)2 với các điện cực trơ.
Số thí nghiệm tạo thành kim loại là
 Xem đáp án
Xem đáp án
1) Mg + Fe2(SO4)3 dư → MgSO4 + 2FeSO4 => không tạo thành kim loại
(2) H2 không phản ứng với MgO =>không tạo thành kim loại
(3) AgNO3 + Fe(NO3)2 → Ag↓ + Fe(NO3)3
(4) 2Na + 2H2O → 2NaOH + H2
2NaOH + MgSO4 → Mg(OH)2 + Na2SO4 =>không tạo thành kim loại
(5) Hg(NO3)2 → Hg↓ + 2NO2 + O2
(6) Ag2S+ O2 → 2Ag + SO2
(7) 2Cu(NO3)2 + 2H2O → 2Cu + O2 + 4HNO3
Vậy thí nghiệm thu được kim loại là (3); (5); (6); (7).