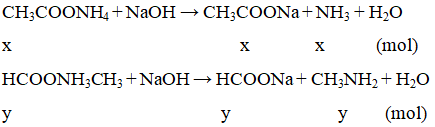SBT Hóa học 12 Bài 12: Luyện tập: Cấu tạo và tính chất của amin, amino axit và protein
-
399 lượt thi
-
16 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 4:
Trong các tên gọi dưới đây, tên nào không phù hợp với chất CH3-CH(CH3)-CH(NH2)-COOH ?
 Xem đáp án
Xem đáp án
Đáp án A.
Câu 7:
Dung dịch của chất nào trong các chất dưới đây không làm đổi màu quỳ tím ?
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 8:
Trong các chất dưới đây, chất nào tham gia phản ứng thế nguyên tử hiđro của vòng thơm bằng nguyên tử brom khó khăn nhất
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 10:
Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,80 lít khí CO2 ; 2,80 lít khí N2 (các thể tích khí đo ở đktc) và 20,25 g H2O. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Đáp án D.
Câu 11:
Cho hỗn hợp X gồm hai chất hữu cơ có cùng công thức phân tử C2H7NO2 tác dụng vừa đủ với dung dịch NaOH, đun nóng thu được dung dịch Y và 4,48lít (đktc) hỗn hợp Z gồm hai khí (đều làm xanh giấy quỳ tím ẩm). Tỉ khối của Z đối với H2 bằng 13,75. Cô cạn dung dịch Y thu được muối khan có khối lượng là
 Xem đáp án
Xem đáp án
Đáp án B.
X + NaOH tạ ra hỗn hợp khí Z đều làm xanh quỳ tím nên X gồm:
CH3COONH4 (x mol) và HCOONH3CH3 (y mol)
Tỉ khối hơi của Z so với H2 là 13,75, sử dụng sơ đồ đường chéo ta có: 3x = y (1)
nZ = 0,2 ⇒ x + y = 0,2 (2)
Từ (1)(2) ⇒ x = 0,05; y = 0,15
Khối lượng hỗn hợp muối = 0,05.82 + 0,15.68 = 14,3g
Câu 12:
Hãy viết công thức cấu tạo của tất cả các tripeptit có chứa gốc của cả hai amino axit là glyxin và alanin.
 Xem đáp án
Xem đáp án
Từ hai amino axit là glyxin và alanin có thể tạo ra 6 tripeptit sau đây :
H2N - CH2 - CO - NH - CH2 - CO - NH- CH(CH3) - COOH
H2N - CH(CH3) - CO - NH - CH2 - CO - NH - CH2 - COOH
H2N - CH2 - CO - NH - CH(CH3) - CO - NH - CH2 - COOH
H2N - CH(CH3) - CO - NH - CH(CH3) - CO- NH - CH2 - COOH
H2N - CH2 - CO - NH - CH(CH3) - CO - NH - CH(CH3) - COOH
H2N - CH(CH3) - CO - NH - CH2 - CO - NH - CH(CH3) - COOH
Câu 13:
Chất X có công thức phân tử C4H9O2N và là este của amino axit. Hãy viết các công thức cấu tạo có thể có của X và ghi tên tương ứng.
 Xem đáp án
Xem đáp án
Các công thức cấu tạo phù hợp ỉà :
H2N - CH2 - CH2COOCH3 metyl β-aminopropionat
CH3-CH(NH2)-COOCH3 metyl α-aminopropionat
H2N-CH2COOCH2-CH3 etyl aminoaxetat.
Câu 14:
Chất X là một muối có công thức phân tử C3H10N2O3. Khi cho X tác dụng với KOH ta thu được một amin bậc ba và các chất vô cơ.
Hãy viết công thức cấu tạo và tên của chất X.
Viết phương trình hoá học của phản ứng giữa X và KOH.
 Xem đáp án
Xem đáp án
Chất X có CTCT: [(CH3)3NH]+NO3-
Trimetylamoninitrat
[(CH3)3NH]+NO3- + KOH → (CH3)3N + KNO3 + H2O
Trimetylamin
Câu 15:
Hỗn hợp A ở thể lỏng chứa hexan và một amin đơn chức. Làm bay hơi 11,6 g A thì thể tích hơi thu được đúng bằng thể tích của 4,8 g oxi ở cùng nhiệt độ và áp suất. Trộn 4,64 g A với m gam O2 (lấy dư) rồi đốt cháy. Sau phản ứng thu được 6,48 g nước và 7,616 lít hỗn hợp khí gồm CO2, N2 và O2 còn dư. Dẫn hỗn hợp khí này qua dung dịch NaOH (có dư) thì thể tích còn lại là 1,344 lít (các thể tích ở đktc).
a) Xác định công thức phân tử, công thức cấu tạo, tên và phần trăm về khối lượng của amin trong hỗn hợp A.
b) Tính m.
 Xem đáp án
Xem đáp án
a) Số mol hai chất trong 11,6g A = 4,8/32 = 0,15 mol
Số mol hai chất trong 4,64g A = 0,15. 4,64/11,6 = 0,6 mol
2C6H14 + 19O2 → 12CO2 + 14H2O
CxHyN + (x+y/4)O2 → xCO2 + y/2H2O + 1/2N2
Số mol H2O = 6,4/18 = 0,36 mol
mH = 0,36 x 2 = 0,72g
Số mol CO2 + N2 + O2 còn dư = 7,616/22,4 = 0,34 mol
Số mol N2 + O2 còn dư = 1,344/22,4 = 0,06
số mol CO2 = 0,34-0,06 = 0,28mol
→ m C = 0,28.12= 3,36g
→ m N trong 4,64 g A = 4,64-3,36-0,72 = 0,56g
Số mol CxHyN = 0,56/14 = 0,04 mol
→ n C6H14 = 0,06- 0,04= 0,02mol
Khi đốt 0,02 mol C6H14 sinh ra 0,12 mol CO2 và 0,14 mol H2O. Vậy khi đốt 0,04 mol CxHyN số mol CO2 sinh ra là 0,28 - 0,12 = 0,16 mol
Số mol H2O là: 0,36- 0,14= 0,22 mol
Vậy x = 0,016/0,04 = 4; y/2 = 0,22/0,4 = 5,5 => y = 11
Công thức phân tử là C4H11N.
Các công thức cấu tạo :
CH3 - CH2 - CH2 - CH2 - NH2 butylamin
CH3- CH(CH3)-CH2-NH2 isobutylamin
CH3-CH2-CH(CH3)-NH2 sec-butylamin
CH3 - CH2 - CH2 - NH - CH3 metylpropylamin
CH3 – CH(CH3) - NH - CH3 metylisopropylamin
CH3 - CH2 - NH - CH2 - CH3 đietylamin
CH3 – N(CH3) -CH2 -CH3 etylđimetylamin
%mC4H11N = 0,04.73/4,64 . 100% = 62,93%
b) Khối lượng O trong 0,36 mol H2O là : 0,36.16 = 5,76 (g)
Khối lượng O trong 0,28 mol CO2 là : 0,28.32 = 8,96 (g)
Số mol O2 còn dư : 0,06 - 0,56/28 = 0,04 mol
Khối lượng O2 còn dư : 0,04.32 = 1,28 (g).
Khối lượng O2 ban đầu : m = 5,76 + 8,96 + 1,28 = 16 (g).
Câu 16:
Người ta đốt cháy 4,55 g chất hữu cơ X bằng 6,44 lít O2 (lấy dư). Sau phản ứng thu được 4,05 g H2O và 5,6 lít hỗn hợp khí gồm CO2, N2 và O2 còn dư. Các thể tích đo ở đktc. Dẫn hỗn hợp khí này đi qua dung dịch NaOH (dư) thì còn lại hỗn hợp khí có tỉ khối đối với hiđro là 15,5.
a) Xác định công thức đơn giản nhất của X.
b) Xác định công thức phân tử, biết rằng phân tử khối của X là 91.
Viết công thức cấu tạo và tên của X, biết rằng X là muối, vừa phản ứng được với dung dịch NaOH, vừa phản ứng được với dung dịch HCl.
 Xem đáp án
Xem đáp án
Đặt lượng CO2 là a mol, lượng N2 là b mol, lượng O2 còn dư là c mol.
Ta có : a + b + c = 5,6/22,4 = 0,25 mol (1)
44a + 28b + 32c = 4,55 + 6,44/22,4 x 32 - 4,05 = 9,7 (2)
(28b + 32c)/(b+c) = 15,5.2 = 31 (3)
Giải hệ phương trình, tìm được : a = 0,15 ; b = 0,025 ; c = 0,075.
Khối lượng C trong 4,55 g X : 0,15.12 = 1,8 (g).
Khối lượng H trong 4,55 g X : 2,4.0,5/18 = 0,45g
Khối lượng N trong 4,55 g X : 0,025.28 = 0,7 (g).
Khối lượng O trong 4,55 g X : 4,55 - 1,8 - 0,45 - 0,7 = 1,6 (g).
Chất X có dạng CxHyNzOt.
x : y : z : t = 1,8/2 : 0,45/1 : 0,7/14 : 1,6/16
= 0,15:0,45:0,05:0,10 = 3:9: 1 :2
Công thức đơn giản nhất của X là C3H9NO2.
Vì M = 91 nên công thức phân tử của X cũng là C3H9NO2. Các công thức cấu tạo phù hợp :
CH3 - CH2 – COO- (NH4)+ ; CH3 – COO-(CH3NH3)+
amoni propionat metylamoni axetat
HCOO-(C2H5NH3)+ ; HCOO-((CH3)2NH2)+
etylamoni fomat đimetylamoni fomat