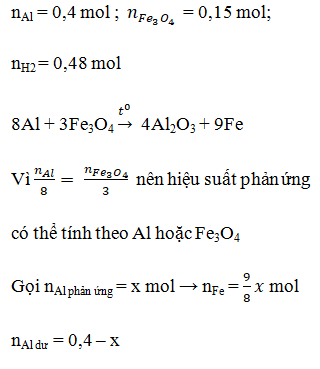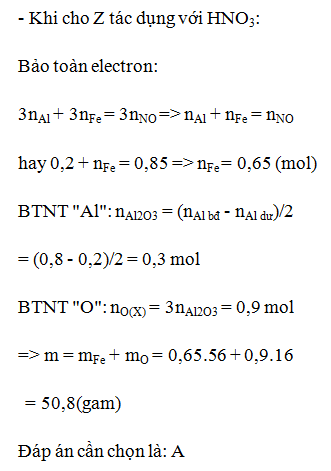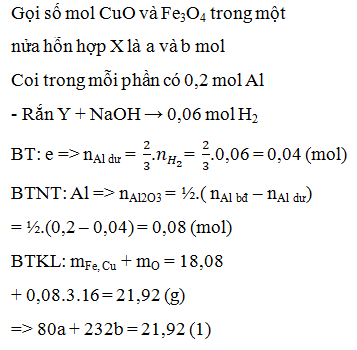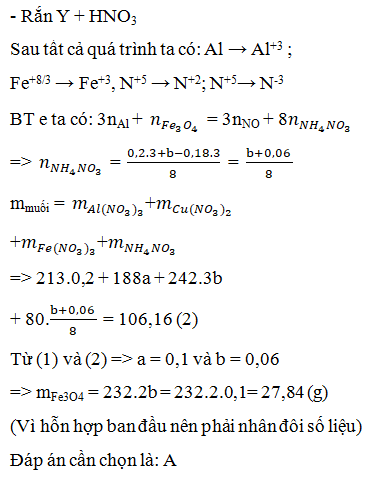Trắc nghiệm Nhôm và hợp chất của Nhôm có đáp án (Vận dụng)
-
812 lượt thi
-
10 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Cho Al lần lượt vào các dung dịch : H2SO4 loãng, HNO3 (đậm đặc, to), Ba(OH)2, HNO3 loãng, H2SO4 đặc, thấy sinh ra khí B có tỉ khối so với O2 nhỏ hơn 0,8. Số dung dịch có thể phù hợp là :
 Xem đáp án
Xem đáp án
MB < 32.0,8 = 25,6
Al + H2SO4 loãng → H2 (thỏa mãn)
Al + HNO3 đặc, to → NO2 (loại)
Al + Ba(OH)2 → H2 (thỏa mãn)
Al + HNO3 loãng → N2 hoặc N2O hoặc NO tất cả khối lượng mol của chúng đều ≥ 28 không thỏa mãn
Al + H2SO4 đặc, to → SO2 (hoặc H2S) loại
Đáp án cần chọn là: A
Câu 2:
Cho các phát biểu sau:
a, Al tan được trong dung dịch HCl và dung dịch NaOH.
b, Al khử được Cu2+ trong dung dịch.
c, Al3+ bị khử bởi Na trong dung dịch AlCl3.
d, Al2O3 là hợp chất kém bền với nhiệt.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Al tan được trong dung dịch HCl và dung dịch NaOH => a, đúng
Al mạnh hơn Cu => Al khử được Cu2+ trong dung dịch => b đúng
Vì Na phản ứng với nước trong dung dịch tạo NaOH => Al3+ không bị khử bởi Na trong dung dịch AlCl3 => c, sai
Al2O3 là hợp chất bền với nhiệt => d sai
Đáp án cần chọn là: B
Câu 3:
Cho bốn hỗn hợp, mỗi hỗn hợp gồm hai chất rắn có số mol bằng nhau: Na2O và Al2O3; Cu và Fe2(SO4)3; BaCl2 và CuCl2 ; Ba và NaHSO4. Số hỗn hợp có thể tan hoàn toàn trong nước (dư) chỉ tạo ra dung dịch là
 Xem đáp án
Xem đáp án
1) Na2O và Al2O3
nNaOH = 2nNa2O = 2 mol
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
2 mol 1 mol
=> hỗn hợp tan hết
2) Cu và Fe2(SO4)3
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
1 mol 1 mol
=> hỗn hợp tan hết
3) BaCl2 và CuCl2 : hỗn hợp tan hết
4) Ba và NaHSO4
Ba(OH)2 + 2NaHSO4 → BaSO4 ↓ + Na2SO4 + H2O
Hỗn hợp tan tạo kết tủa và khí H2
=> có 3 hỗn hợp hòa tan vào nước chỉ tạo thành dung dịch
Đáp án cần chọn là: D
Câu 4:
Có các hỗn hợp chất rắn
(1) FeO, BaO, Al2O3 (tỉ lệ mol 1: 1 : 1)
(2) Al, K, Al2O3 (tỉ lệ mol 1: 2: 1)
(3) Na2O, Al (tỉ lệ mol 1: 1)
(4) K2O, Zn (tỉ lệ mol 1: 1)
Số hỗn hợp tan hết trong nước (dư) là :
 Xem đáp án
Xem đáp án
(1) không tan hết vì có FeO
(2) nKOH = nK = 2 mol
=> hỗn hợp không tan hết
(3) nNaOH = 2nNa2O = 2 mol
Vì nNaOH > nAl => hỗn hợp tan hết
(4) nKOH = 2nK2O = 2 mol
2KOH + Zn → K2ZnO2 + H2
2 mol 1 mol
=> hỗn hợp tan hết
Nhận xét: nếu nK ≥ nAl hoặc nK ≥ 2nZn thì hỗn hợp tan hết
Đáp án cần chọn là: D
Câu 5:
Cho các phương trình phản ứng sau đây
X + Y + 2H2O → Z + T (1)
T + NaOH → X + 2H2O (2)
Y + 2NaOH → E + H2O (3)
Y + E + H2O → 2Z (4)
2AlCl3 + 3E + 3H2O → 2T + 3Y + 6NaCl
Các chất Z, T, E là
 Xem đáp án
Xem đáp án
Các chất Z, T, E là NaHCO3, Al(OH)3, Na2CO3
NaAlO2 (X) + CO2 (Y) + 2H2O → NaHCO3(Z) + Al(OH)3 (T) (1)
Al(OH)3 (T) + NaOH → NaAlO2 (X) + 2H2O (2)
CO2 (Y) + 2NaOH → Na2CO3 (E) + H2O (3)
CO2 (Y) + Na2CO3 (E) + H2O → 2NaHCO3 (Z) (4)
2AlCl3 + 3Na2CO3 (E) + 3H2O → 2Al(OH)3 (T) + 3CO2 (Y) + 6NaCl (5)
Đáp án cần chọn là: D
Câu 6:
Cho các chất : Al, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3. Số chất có tính lưỡng tính là :
 Xem đáp án
Xem đáp án
Chất có tính lưỡng tính là chất tác dụng được với dung dịch NaOH và dung dịch HCl và không làm thay đổi số oxi hóa
=> Al2O3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3 là những chất lưỡng tính
Đáp án cần chọn là: B
Câu 8:
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03mol Cr2O3; 0,04mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều thu được hỗn hợp chất rắn Y. Chia Y thành 2 phần bằng nhau. Phần I phản ứng vừa đủ với 400ml dung dịch NaOH 0,1M (loãng). Phần II phản ứng với dung dịch HCl loãng, nóng (dư) thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. % khối lượng Cr2O3 đã phản ứng là:
 Xem đáp án
Xem đáp án
- Chất rắn thu được sau phản ứng nhiệt nhôm chỉ có Al2O3 và Al còn dư (nếu có) tham gia phản ứng với NaOH:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al + NaOH + H2O → NaAlO2 + 3/2H2
nNaOH = 2nAl2O3 + nAl dư = nAl ban đầu → a = 2nNaOH = 0,08mol (vì ½ Y chỉ phản ứng với 0,04 mol NaOH).
- Nhận thấy trong phản ứng nhiệt nhôm, Al nhường e cho Cr2O3 và FeO.
Hỗn hợp rắn sau phản ứng cho tác dụng với HCl loãng nóng dư thì Cr chuyển thành Cr2+; Fe chuyển thành Fe2+; Al chuyển thành Al3+; FeO chuyển thành Fe2+; Cr2O3 chuyển thành Cr3+; Al2O3 chuyển thành Al3+.
Số mol e trao đổi của phần II là ne (II) = 2nH2 = 2nCr + 2nFe + 3nAl dư = 0,1 mol.
- Bảo toàn e : 3nAl – 2ne (II) = nCr = 0,04 → nCr2O3 phản ứng = 1/2.nCr = 0,02
→ %Cr2O3 phản ứng = 0,02.100% / 0,03 = 66,67%
Đáp án cần chọn là: A