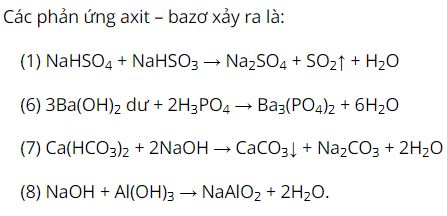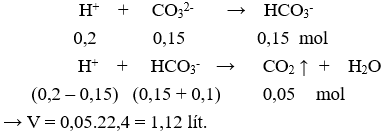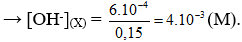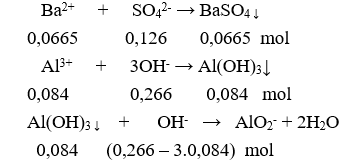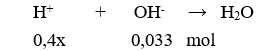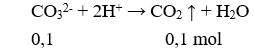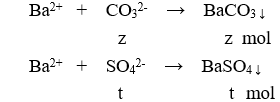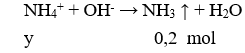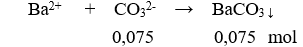Đề thi giữa kì 1 Hóa 11 có đáp án (Trắc nghiệm - Bài số 1 - Đề 1)
-
1228 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 3:
Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
 Xem đáp án
Xem đáp án
Chọn D
A sai vì là phản ứng hóa hợp.
B sai vì là phản ứng thế.
C sai vì không thỏa mãn điều kiện xảy ra phản ứng trao đổi.
Câu 4:
Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 0,5M và 0,5M vào 100 ml dung dịch X chứa hỗn hợp gồm 1,5M và 1M, thu được V lít khí (ở đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn A
Phản ứng xảy ra theo thứ tự:
Câu 5:
Tiến hành các thí nghiệm sau:(1) Sục khí vào dung dịch . (2) Sục khí vào dung dịch . (3) Sục khí vào dung dịch NaOH dư. (4) Sục khí (dư) vào dung dịch . (5) Sục và dung dịch dư. (6) Nhỏ từ từ dung dịch vào dung dịch . (7) Nhỏ từ từ dung dịch đến dư vào dung dịch . (8) Nhỏ từ từ dung dịch đến dư vào dung dịch . Số thí nghiệm tạo ra kết tủa là
 Xem đáp án
Xem đáp án
Chọn A
Câu 6:
Chất X là muối khi tan trong nước tạo ra dung dịch có môi trường axit. Khi cho X tác dụng với dung dịch dư hay dung dịch KOH dư đều thu được kết tủa (sau khi phản ứng xảy ra hoàn toàn). X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 7:
Quỳ tím hóa đỏ khi cho vào dung dịch có pH nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C
Dung dịch có môi trường axit (pH < 7) làm quỳ tím chuyển sang màu đỏ.
Câu 8:
Một dung dịch có thì dung dịch đó có môi trường
 Xem đáp án
Xem đáp án
Chọn B
Dung dịch có thì có môi trường bazơ.
Câu 9:
Dung dịch X gồm 0,15 mol ; 0,3 mol ; 0,25 mol ; a mol và b mol . Cô cạn dung dịch X thu được 61,8 gam muối khan. Giá trị của b là
 Xem đáp án
Xem đáp án
Chọn B
Câu 11:
Trong số các chất sau: , HCOOH, , NaClO, . Số chất thuộc loại chất điện li yếu là
 Xem đáp án
Xem đáp án
Chọn D
Các chất điện li yếu là:
Câu 12:
Trộn 100 ml dung dịch NaOH có pH = 11 với 50 ml dung dịch KOH có pH = 12 thu được dung dịch X. Nồng độ ion OH trong dung dịch X là
 Xem đáp án
Xem đáp án
Chọn C
pH = 11 → (M)
pH = 12 → (M)
Tổng số mol có trong dung dịch X là: n = (mol)
Câu 13:
Khi thêm một ít dung dịch HCl vào dung dịch thì nồng độ ion trong dung dịch thu được sẽ thay đổi như thế nào so với dung dịch ban đầu?
 Xem đáp án
Xem đáp án
Chọn B
Thêm HCl (tức thêm ) cân bằng chuyển dịch theo chiều nghịch (chiều làm giảm nồng độ ion ).
Câu 14:
Cho 0,266 lít dung dịch X gồm NaOH 0,5M và 0,25M vào 140 ml dung dịch 0,3 M thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B
Kết tủa sau phản ứng gồm:
: 0,0665 mol và : 0,084 – 0,014 = 0,07 mol.
m = 0,0665.233 + 0,07.78 = 20,9545 gam.
Câu 17:
Trong dung dịch có tất cả bao nhiêu anion (bỏ qua sự phân li của nước)?
 Xem đáp án
Xem đáp án
Chọn C
Bỏ qua sự phân li của nước trong dung dịch có 3 anion là:
Câu 18:
Cho 100ml dung dịch X chứa KOH 0,13M và 0,1M tác dụng với 200ml dung dịch x mol/lít. Sau khi phản ứng kết thúc thu được dung dịch có pH = 2. Giá trị của x là
 Xem đáp án
Xem đáp án
Chọn B
Dung dịch sau phản ứng có pH = 2 < 7 nên dung dịch sau phản ứng có dư
→ 0,4x – 0,033 = .0,3 → x = 0,09
Câu 19:
Dung dịch nào sau đây không dẫn điện?
 Xem đáp án
Xem đáp án
Chọn B
Glucozơ trong nước không phân li ra ion nên không dẫn điện.
Câu 21:
Có 500 ml dung dịch X chứa . Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch thu được 43 gam kết tủa. Lấy 200 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu được 8,96 lít khí . Các phản ứng hoàn toàn, các thể tích khí đều đo ở đktc. Tổng khối lượng muối có trong 300 ml dung dịch X là
 Xem đáp án
Xem đáp án
Chọn A
Gọi số mol trong 100ml dung dịch X lần lượt là x, y, z và t.
Bảo toàn điện tích có: x + y – 2z – 2t = 0 (1)
Cho 100ml X tác dụng với HCl dư:
→ z = 0,1 (2)
Cho 100ml X tác dụng với BaCl2 dư:
m↓ = 43 (gam) → 197z + 233t = 43 (3)
Cho 100 ml X tác dụng với NaOH
→ y = 0,2 (4)
Từ (1); (2); (3); (4) có x = y = 0,2; z = 0,1; t = 0,1.
Tổng khối lượng muối trong 300ml dung dịch là:
m = 3. (0,2.23 + 0,2.18 + 0,1.60 + 0,1.96) = 71,4 gam.
Câu 22:
Một dung dịch có chứa các ion: (0,1 mol), (0,15 mol), (0,1 mol), và (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
m↓ = 0,075.197 = 14,775 gam.
Câu 23:
Cho các chất sau: ; ; Ag; ; Al; Zn; CuS. Số chất tác dụng được với HCl là
 Xem đáp án
Xem đáp án
Chọn C
Các chất tác dụng với HCl là ; ; ; Al; Zn
Câu 24:
Cho từ từ z mol khí CO2 vào hỗn hợp A gồm x mol NaOH và y mol thấy kết tủa xuất hiện, tăng dần đến cực đại và tan đi một phần. Sau phản ứng, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn A
Câu 25:
Cho các phản ứng sau:
(1) →; (2) →; (3) →; (4) → ; (5) →; (6) → .
Các phản ứng đều có cùng một phương trình ion rút gọn là:
 Xem đáp án
Xem đáp án
Chọn A
(1), (2), (3), (6) có cùng phương trình ion rút gọn là:
Câu 26:
Muối nào sau đây là muối axit?
 Xem đáp án
Xem đáp án
Chọn A
Muối axit là muối mà gốc axit vẫn còn Hiđro có thể phân li ra ion .
→ là muối axit.
Câu 27:
Cho hỗn hợp gồm Na và Ba tan hoàn toàn trong nước thu được dung dịch X và 1,008 lít khí (ở đktc). Thể tích dung dịch chứa HCl 1M và 1M cần dùng để trung hòa X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 29:
Trong số các chất sau: , , , , số chất điện li là
 Xem đáp án
Xem đáp án
Chọn A
Các chất điện li là: , .
Câu 30:
Cho các dung dịch có cùng nồng độ 0,01M: (1); (2); NaOH (3); (4). Thứ tự giảm dần giá trị pH của các dung dịch đó là
 Xem đáp án
Xem đáp án
Chọn B
Thứ tự giảm dần pH:
(pH = 12,3) > NaOH (pH = 12) > (pH = 7) > (pH = 1,7).