Bộ đề thi học kì 2 Hóa 12 có đáp án (Mới nhất) - Đề số 1
-
1832 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chất nào sau đây là chất điện li mạnh?
 Xem đáp án
Xem đáp án
A. HF ⇄ H+ + F–.
B. KOH → K+ + OH–.
C. Al(OH)3 ⇄ Al(OH)2+ + OH–.
D. Cu(OH)2 ⇄ Cu(OH)+ + OH–.
Chọn đáp án B.
Câu 2:
Khi so sánh trong cung một điều kiện thì Cr là kim loại có tính khử mạnh hơn :
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 3:
Kim loại M phản ứng được với: dung dịch HCl, dung dịch Cu(NO3)2, dung dịch HNO3 đặc nguội. Kim loại M là:
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 4:
Phân hủy Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 7:
Cho 19,2 gam kim loại M tác dụng với dung dịch HNO3 loãng dư, thu được 4,48 lít khí NO duy nhất. Kim loại M là:
 Xem đáp án
Xem đáp án
n NO = 0,2 mol nên nelectron= 0,2.3 =0,6 mol
giả sử M hóa trị II thì n M = 0,3 mol
MM=19,2:0,3 =64 (Cu)
Chọn đáp án B.
Câu 10:
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 12:
Dung dịch chứa muối X không làm quỳ hóa đỏ, dung dịch chứa muối Y làm quỳ hóa đỏ. Trộn 2 dung dịch trên với nhau thấy sản phẩm có kết tủa và có khí bay ra. Vậy X, Y lần lượt là
 Xem đáp án
Xem đáp án
- X không làm quỳ tím hóa đỏ => loại C
- Y làm quỳ tím hóa đỏ => chọn B.
Chọn đáp án B.
Câu 13:
Cho V lít CO (đktc) phản ứng với một lượng dư hỗn hợp chát rắn gồm Al2O3 và Fe3O4 nung nóng. Sau khi phản ứng hoàn toàn khối lượng chất rắn giảm 0,32 gam. Giá trị của V là
 Xem đáp án
Xem đáp án
Chú ý Al2O3 không bị khử bởi CO
Như vậy chỉ có Fe3O4 phản ứng
→ khối lượng chất rắn giảm chính là khối lượng O
→ 0,02 mol
Bản chất: CO + O → CO2
→ nCO = 0,02 mol → V = 0,448 lít
Chọn đáp án A.
Câu 14:
 Xem đáp án
Xem đáp án
nAl = 0,54
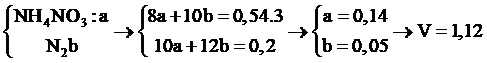
Chọn đáp án A.
Câu 15:
Cho khí CO dư đi hỗn hợp X gồm CuO, FeO và MgO nung nóng thu được hỗn hợp Y. Cho Y vào dung dịch FeCl3 dư thu được chất rắn Z. Vậy Z là
 Xem đáp án
Xem đáp án
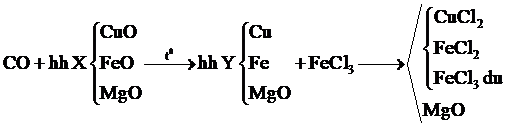
Chọn đáp án C.
Câu 16:
Cho sơ đồ phản ứng sau
R+2HCL (loãng)
Kim loại R
 Xem đáp án
Xem đáp án
Nhìn 2 phương trình đầu có 2 hóa trị II và III
Chọn đáp án A.
Câu 17:
Kim loại nào dưới đây trong thực tế được điều chế bằng cả 3 phương pháp: thủy luyện, nhiệt luyện và điện phân?
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 18:
 Xem đáp án
Xem đáp án
Trong quá trình điện phân, cực dương sẽ bị mòn dần và được hạ thấp dần xuống.
Chọn đáp án C.
Câu 19:
Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác bằng cách đẩy nước như hình vẽ bên. Khí X được tạ o ra từ phản ứng hoá học nào sau đây?
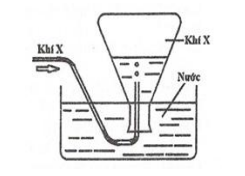
 Xem đáp án
Xem đáp án
Thu X bằng cách phương pháp đẩy nước =>X ít tan hoặc không tan trong nước.
=>loại B,C và D vì các khí sinh ra tan tốt trong H20 => chọn A.
Chọn đáp án A.
Câu 20:
Cho các chất: NaHCO3, CO, Al(OH)3, Fe(OH)3, CO2, NH4Cl. Số chất tác dụng được với dung dịch NaOH ở nhiệt độ thường là
 Xem đáp án
Xem đáp án
Các chất phản ứng với NaOH ở t0 thường là: NaHCO3; Al(OH)3; CO2; NH4Cl => có 4 chất
Chọn đáp án D.
Câu 21:
Cho các chất sau: Fe, FeO, Fe2O3, Fe3O4, Fe(NO3)2, FeS2, FeCO3, Fe(OH)2, Fe(OH)3, Fe(NO3)3 lần lượt tác dụng với dung dịch HNO3 loãng. Số phương trình phản ứng oxi hóa – khử là
 Xem đáp án
Xem đáp án
Các phản ứng oxi hóa khử xảy ra giữa HNO3 với các chất: Fe, FeO, Fe3O4, Fe(NO3)2, FeS2, FeCO3, Fe(OH)2
Chọn đáp án A.
Câu 22:
Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, Al2O3, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm những chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 23:
Hòa tan hoàn toàn 2,72 gam hỗn hợp X chứa Fe và Mg bằng lượng vừa đủ dung dịch HCl thu được dung dịch Y và 1,344 lít khí (đktc). Cho AgNO3 dư vào Y thấy có m gam kết tủa xuất hiện. Giá trị của m là:
 Xem đáp án
Xem đáp án
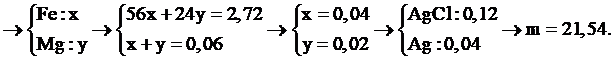
Chọn đáp án D.
Câu 24:
 Xem đáp án
Xem đáp án
Fe + 2HCl → FeCl2 + H2↑
0,15← 0,15 (mol)
=> mFeCl2 = 0,15. 127 = 19,05 (g)
Chọn đáp án C.
Câu 25:
Cho hai muối X, Y thỏa mãn điều kiện sau:
X + Y → không xảy ra phản ứng X + Cu → không xảy ra phản ứng
Y + Cu → không xảy ra phản ứng X + Y + Cu → xảy ra phản ứng
 Xem đáp án
Xem đáp án
X là NaNO3 và Y là NaHSO4
NaNO3 + NaHSO4 → Không phản ứng
NaNO3 + Cu → Không phản ứng
NaHSO4+ Cu → Không phản ứng
2NaNO3 + 8NaHSO4 + 3Cu → 5Na2SO4 + 3CuSO4 + 2NO↑ + 4H2O
Chọn đáp án B.
Câu 26:
Cho X là một oxit của sắt có đặc điểm là khi tan vào dung dịch H2SO4 loãng dư thì tạo ra dung dịch Y. Biết dung dịch Y vừa có khả năng hòa tan Cu, vừa có khả năng làm mất màu dung dịch Br2 và dung dịch KMnO4. X là
 Xem đáp án
Xem đáp án
Y có khả năng hòa tan Cu → Y chứa Fe3+; Y có khả năng làm mất màu dung dịch Br2 và dung dịch KMnO4 → Y chứa Fe2+ → X = Fe3O4
Chọn đáp án B.
Câu 27:
Cho các thí nghiệm sau:
(1) Nhỏ dung dịch Na2CO3 vào dung dịch BaCl2.
(2) Cho dung dịch NH3 vào dung dịch HCl.
(3) Sục khí CO2 vào dung dịch HNO3.
(4) Nhỏ dung dịch NH4Cl vào dung dịch NaOH.
Số thí nghiệm xảy ra phản ứng hóa học là
 Xem đáp án
Xem đáp án
(2) NH3 + HCl → NH4Cl
(3) Không phản ứng.
(4) NH4Cl + NaOH → NaCl + NH3 + H2O
Câu 28:
Trong các thí nghiệm sau:
(1) Cho SiO2 tác dụng với axit HF.
(2) Cho khí SO2 tác dụng với khí H2S.
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag.
(7) Cho dung dịch NH4Cl tác dụng với dung dịch NaNO2 đun nóng
(8) Điện phân dung dịch Cu(NO3)2
(9) Cho Na vào dung dịch FeCl3
(10) Cho Mg vào lượng dư dung dịch Fe2(SO4)3.
Số thí nghiệm tạo ra đơn chất là
 Xem đáp án
Xem đáp án
(2) SO2 + 2H2S → 3S + 2H2O
(3) 2NH3 + 3CuO → 3Cu + N2 + 3H2O
(4) CaOCl2 + 2HClđặc → CaCl2 + Cl2 + H2O
(5) Si + 2NaOH + H2O → Na2SiO3 + 2H2
(6) 2Ag + O3 → Ag2O + O2
(7) NH4Cl + NaNO2 → NaCl + N2 + 2H2O
(8) 2Cu(NO3)2 + 2H2O → 2Cu + 4HNO3 + O2
(9) 2Na + 2H2O → 2NaOH + H2 || 3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
(10) Mg + Fe2(SO4)3dư → MgSO4 + 2FeSO4
⇒ (2), (3), (4), (5), (6), (7), (8), (9) thỏa ⇒ chọn A
Câu 29:
Điện phân 200ml dung dịch X chứa Cu(NO3)2 1M trong thời gian 5790 giây với cường độ dòng điện một chiều I = 2,5 A. Ngắt dòng điện rồi cho ngay 200 ml dung dịch HNO3 0,5M vào bình điện phân, sau khi các phản ứng hoàn toàn thu được V lít khí NO (đktc, sản phẩm khử duy nhất của N+5). Giá trị của V là:
 Xem đáp án
Xem đáp án
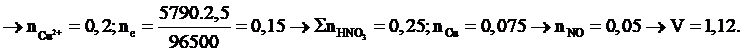
Chọn đáp án D.
Câu 30:
 Xem đáp án
Xem đáp án
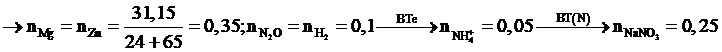
Chọn đáp án B.
