Bộ đề thi học kì 2 Hóa 12 có đáp án (Mới nhất) - Đề số 5
-
1769 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 2:
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 4:
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 6:
Cho dung dịch Fe2(SO4)3 tác dụng với kim loại Cu được FeSO4 và CuSO4. Cho dung dịch CuSO4 tác dụng với kim loại Fe được FeSO4 và Cu. Qua các phản ứng xảy ra ta thấy tính oxi hoá của các ion kim loại giảm dần theo dãy sau
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 8:
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 9:
Cho bột Cu đến dư vào dung dịch hỗn hợp gồm Fe(NO3)3 và AgNO3 thu được chất rắn X và dung dịch Y. X, Y lần lượt là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 10:
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 11:
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 12:
Cho các chất sau: NaHCO3 , NaOH , HCl , Ca(HCO3)2. Số phản ứng hoá học xảy ra khi ta trộn chúng từng đôi một với nhau là:
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 14:
Dung dịch X chứa một lượng lớn các ion Ca2+, Mg2+, Cl-, SO42-. Dung dịch X là loại
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 16:
Thực hiện các thí nghiệm sau:
(a) Cho Al vào dung dịch HCl.
(b) Cho Al vào dung dịch AgNO3.
(c) Cho Na vào H2O.
(d) Cho Ag vào dung dịch H2SO4 loãng.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Số thí nghiệm xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Các thí nghiệm : (a) ; (b) ; (c) ; (e)
Chọn đáp án A.
Câu 17:
Phát biểu nào sau đây không đúng khi so sánh tính chất hóa học của Al và Cr ?
 Xem đáp án
Xem đáp án
Cr+2HCl→CrCl2+H2
2Al+6HCl→2AlCl3+3H2
Chọn đáp án A.
Câu 18:
 Xem đáp án
Xem đáp án
Phương pháp nhiệt luyện chỉ điều chế được các kim loại sau Al
Chọn đáp án C.
Câu 19:
 Xem đáp án
Xem đáp án
Bảo toàn e:
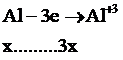
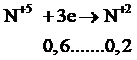
→ 3x=0,6→ x = 0,63 → m = 5,4 (g)
Chọn đáp án D.
Câu 20:
 Xem đáp án
Xem đáp án
2NaOH + Al2O3 → 2NaAlO2 + H2O
0,2................... 0,1
→ mAl2O3= 0,1. 102 = 10,2 g
Chọn đáp án B.
Câu 21:
Phát biểu nào sau đây sai
 Xem đáp án
Xem đáp án
Cr2O3 là oxit lưỡng tính nhưng tan trong axit và kiềm đặc, không tan trong NaOH loãng.
Chọn đáp án D.
Câu 22:
Khử hoàn toàn 4,8 gam Fe2O3 bằng CO dư ở nhiệt độ cao. Khối lượng Fe thu được sau phản ứng là:
 Xem đáp án
Xem đáp án
Ta có: nFe2O3 = 0,03
BTNT (Fe): nFe = 2 nFe2O3 = 0,06 mol → m = 3,36 (g)
Chọn đáp án D.
Câu 23:
Cho 17,6 gam hỗn hợp X gồm Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là ?
 Xem đáp án
Xem đáp án
Có nH2 = 0,2 → nFe = 0,2 => mFeCl2 = 0,2. 127 = 25,4 gam.
Chọn đáp án D.
Câu 24:
Cho một oxit của kim loại M vào bình chứa dung dịch H2SO4 loãng dư, sau khi kết thúc phản ứng, thêm tiếp dung dịch NaOH dư vào bình, thu được dung dịch có màu vàng. Oxit của kim loại M là
 Xem đáp án
Xem đáp án
4CrO3 + 6H2SO4 → 2Cr2(SO4)3 + 3O2 + 6H2O
Cr2(SO4)3 + 6NaOH → 3Na2SO4 + 2Cr(OH)3
Cr(OH)3 + NaOH → NaCrO2+ 2H2O.
Chọn đáp án A.
Câu 25:
Thực hiện các thí nghiệm sau:
(1) Cho Fe2O3 vào dung dịch HNO3 loãng dư.
(2) Cho Fe(OH)3 vào dung dịch HCl loãng dư.
(3) Cho bột sắt đến dư vào dung dịch HNO3 loãng.
(4) Sục khí Cl2 vào dung dịch FeCl2.
(5) Cho bột Fe vào lượng dư dung dịch AgNO3.
(6) Đốt bột sắt dư trong hơi brom.
(7) Đốt cháy hỗn hợp bột gồm sắt và lưu huỳnh trong điều kiện không có không khí.
Số thí nghiệm thu được muối Fe (III) là
 Xem đáp án
Xem đáp án
Các thí nghiệm là: 1, 2, 4, 5, 6.
+ TN1: Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O.
+ TN2: Fe(OH)3 + 3HCl → FeCl3 + 3H2O.
+ TN3: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O.
Fe + 2Fe(NO3)3 → 3Fe(NO3)2.
+ TN4: FeCl2 + ½ Cl2 → FeCl3.
+ TN5: Fe + 2AgNO3 → Fe(NO3)2 + 2Ag.
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag.
+ TN6: 2Fe + 3Br2 → 2FeBr3Câu 26:
Hòa tan một oxit sắt vào dung dịch H2SO4 loãng dư được dung dịch X. Chia dung dịch X làm 2 phần bằng nhau:
- Phần 1: Cho một ít vụn Cu vào thấy tan ra và cho dung dịch có màu xanh
- Phần 2: Cho một vài giọt dung dịch KMnO4 vào thấy bị mất màu.
Oxit sắt là
 Xem đáp án
Xem đáp án
Cho Cu vào dung dịch thấy tan ra và có màu xanh chứng tỏ trong dung dịch có Fe3+: Cu + 2Fe3+ → 2Fe2+ + Cu2+
Cho KMnO4 vào thấy dung dịch bị mất màu → chứng tỏ dung dịch có cả Fe2+ (xảy ra phản ứng oxi hóa khử giữa Fe2+ và KMnO4 do Mn+7 + 5e → Mn+2 và Fe+2 → Fe+3+ 1e
Chọn đáp án B.
Câu 27:
Khử hoàn toàn một oxit của kim loại M bằng khí CO ở nhiệt độ cao, thu được 8,96 gam kim loại M và 5,376 lít khí CO2 (đktc). Oxit của kim loại là
 Xem đáp án
Xem đáp án
Ta có: ![]()
Nếu đáp án là FeO hoặc CuO thì ![]()
Vậy M là Fe ![]()
Vậy oxit cần tìm là Fe2O3,
Chọn đáp án D.
Câu 28:
Cho luồng khí H2 (dư) đi qua hỗn hợp gồm CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau khi kết thúc phản ứng hỗn hợp rắn còn lại là
 Xem đáp án
Xem đáp án
H2 khử được các oxit của kim loại sau Al → Cu, Fe, Zn, MgO
Chọn đáp án D.
Câu 29:
Cho phương trình ion: Cu2+ + 2OH‒ → Cu(OH)2↓.
Phản ứng nào sau đây có phương trình ion thu gọn đã cho?
 Xem đáp án
Xem đáp án
Cu2+ + 2Cl- + 2K+ + 2OH- → Cu(OH)2 + 2K+ + 2Cl-
Cu2+ + 2OH- → Cu(OH)2.
Chọn đáp án A.
Câu 30:
Tiến hành điện phân dung dịch chứa NaCl và 0,15 mol Cu(NO3)2 bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5A trong thời gian 6562 giây thì dừng điện phân, thấy khối lượng dung dịch giảm 15,11 gam. Dung dịch sau điện phân hòa tan tối đa m gam bột Fe, phản ứng tạo ra khí NO (sản phẩm khử duy nhất của N+5). Giá trị m là
 Xem đáp án
Xem đáp án
Ta có:
Do sau điện phân dung dịch hòa tan tối được Fe tạo khí NO nên có tạo ra H+ nên Cl-hết trước Cu2+.
Ở catot sẽ thu được 0,15 mol Cu2+ và 0,02 mol H2.
Ở anot sẽ thu được Cl2 a mol và O2 b mol
Khối lượng dung dịch giảm 15,11 gam
Giải được: a=0,05; b=0,06.
![]()
Khi cho Fe vào xảy ra quá trình:
![]()
Chọn đáp án D.
