Bộ đề thi học kì 2 Hóa 12 có đáp án (Mới nhất) - Đề số 8
-
1827 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 2:
Nhỏ từ từ dung dịch H2SO4 loãng vào dung dịch K2CrO4 thì màu của dung dịch chuyển từ
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 3:
Phân hủy Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được chất rắn là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 6:
Hiện tượng trái đất nóng lên do hiệu ứng nhà kính chủ yếu là do chất nào sau đây
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 7:
Sản phẩm tạo thành có chất kết tủa khi dung dịch Fe2(SO4)3 tác dụng với dung dịch
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 8:
Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 12:
Cho sơ đồ chuyển hoá: FeFeCl3Fe(OH)3 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 18:
Kim loại nào sau đây có tính dẫn điện tốt nhất trong tất cả các kim loại
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 21:
Cặp kim loại nào sau đây bền trong không khí và nước do có màng oxit bảo vệ
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 22:
Hòa tan hoàn toàn 5,65g hỗn hợp trong dung dịch dư thu được 3,36 lit (dktc) và dung dịch X. Dung dịch X cô cạn được m gam muối khan. Giá trị của m là:
 Xem đáp án
Xem đáp án
(*) Phương pháp: Bảo toàn khối lượng
-Lời giải:
![]()
Mol 0,3 0,15
Bảo toàn khối lượng: mMuối muối=16,3g
Chọn đáp án A.
Câu 23:
Nung 5,6 gam Fe trong bình đựng oxi, sau phản ứng thu được 15,2 gam hỗn hợp T chỉ gồm toàn oxit. Hoà tan hoàn toàn T cần vừa đủ V lít dung dịch HCl 2M, giá trị của V là:
 Xem đáp án
Xem đáp án
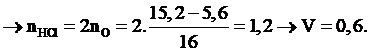
Chọn đáp án B.
Câu 24:
Cho m gam bột Cu vào 400 ml dung dịch AgNO3 0,2M, sau một thời gian phản ứng thu được 7 gam hỗn hợp rắn X và dung dịch Y. Lọc tách X, rồi thêm 3,9 gam bột Zn vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn thu được 6,14 gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
nZn = 0,06 mol > ½ nNO3
=> Zn dư , dung dịch muối Y chỉ có Zn(NO3)2 với số mol là 0,04 mol
Bảo toàn khối lượng :
mZn + mY = mZn(NO3)2 + mrắn => my = 9,8g
Và : mCu + mAgNO3 = mX + mY
=> mCu = m = 3,2g
Chọn đáp án A.
Câu 25:
Cho hai muối X, Y thỏa mãn điều kiện sau:
X + Y → không xảy ra phản ứng; X + Cu → không xảy ra phản ứng;
Y + Cu → không xảy ra phản ứng; X + Y + Cu → xảy ra phản ứng;
X, Y lần lượt có thể là: Xem đáp án
Xem đáp án
X: NaNO3 Y: NaHSO4.
![]()
Chọn đáp án A.
Câu 26:
Cho hỗn hợp X dạng bột gồm Fe, Ag và Cu vào lượng dư dung dịch chứa một muối nitrat Y, khuấy kỹ đến khi phản ứng xảy ra hoàn toàn, thu được dung dịch Z và rắn T chỉ chứa Ag có khối lượng đúng bằng lượng Ag có trong X. Nhận định nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Fe, Ag, Cu + Y → dung dịch Z + Ag
Khối lượng Ag không đổi => Ag không phản ứng với Y, Fe và Cu tan hoàn toàn trong Y
=> A sai. Y không thể là Cu(NO3)2.
B đúng.
C sai. Dung dịch Z không chứa Ag+ nên cho HCl vào Z không thu được kết tủa.
D sai. Dung dịch Z không thể chứa AgNO3.
Chọn đáp án B.
Câu 27:
Có bốn dung dịch đựng riêng biệt trong bốn ống nghiệm không dán nhãn: K2CO3, FeCl2, NaCl, CrCl3. Nếu chỉ dùng một thuốc thử duy nhất là dung dịch Ba(OH)2 thì nhận biết được tối đa bao nhiêu dung dịch trong số các dung dịch trên?
 Xem đáp án
Xem đáp án
Cho Ba(OH)2 phản ứng lần lượt với từng chất:
- Có kết tủa trắng xuất hiện, không tan trong Ba(OH)2 dư: dung dịch là K2CO3.
Ba(OH)2 + K2CO3 → BaCO3 + 2KOH
- Có kết tủa trắng xanh xuất hiện, để lâu kết tủa chuyển màu nâu đỏ: dung dịch là FeCl2.
FeCl2 + Ba(OH)2 → BaCl2 + Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
- Có kết tủa trắng xuất hiện, tan khi thêm dư Ba(OH)2: dung dịch là CrCl3.
3Ba(OH)2 + 2CrCl3 → 2Cr(OH)3 + 3BaCl2
2Cr(OH) + Ba(OH)2 → Ba(CrO2)2 + 4H2O
- Không có hiện tượng gì: dung dịch là NaCl.
Chọn đáp án B.
Câu 28:
Hỗn hợp X gồm Na, Al, Na2O và Al2O3. Hòa tan hoàn toàn 20,05 gam X vào nước, thu được 2,8 lít khí H2 (đktc) và dung dịch Y. Thêm từ từ dung dịch HCl IM yào Y, đến khi bắt đầu xuất hiện kết tủa thì dùng hết 50ml, nếu thêm tiếp 310ml nữa thì thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Y + 0,05 mol HCl → bắt đầu có ↓ ⇒ Y gồm NaOH và NaAlO2.
⇒ nNaOH = nHCl = 0,05 mol. ► Quy X về Na, Al và O. Đặt nAl = x; nO = y.
⇒ nNaAlO2 = x ⇒ nNa/X = (x + 0,05) mol. Bảo toàn electron:
(x + 0,05) + 3x = 2y + 2 × 0,125 || mX = 23.(x + 0,05) + 27x + 16y = 20,05(g).
Giải hệ có: x = 0,25 mol; y = 0,4 mol. "Thêm tiếp" 0,31 mol HCl thì:
1 < nH+ ÷ nAlO2– = 0,31 ÷ 0,25 = 1,24 < 3 ⇒ nH+ = 4nAlO2– - 3nAl(OH)3
⇒ nAl(OH)3 = (4 × 0,25 - 0,31) ÷ 3 = 0,23 mol ⇒ m = 17,94(g)
Chọn đáp án A.
Câu 29:
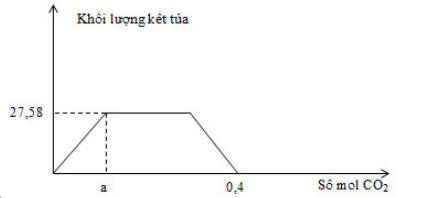
Cho m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào lượng nước dư, thu được dung dịch X và a mol khí H2. Sục khí CO2 đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
 Xem đáp án
Xem đáp án
nBa2+ = n kết tủa max = 27,58/197 = 0,14 mol (tại thời điểm nCO2 = a = 0,14)
Khi nCO2 = 0,4 mol dung dịch thu được gồm: Ba2+ (0,14 mol), HCO3- (0,4 mol) và Na+
BTĐT => nNa+ = 0,12 mol
BT e: 2nBa + nNa = 2nO + 2nH2 => nO = 0,06 mol
m = mBa + mNa + mO = 22,9 gam
Chọn đáp án B.
Câu 30:
Hòa tan hết 23,76 gam hỗn hợp X gồm FeCl2; Cu và Fe(NO3)2 vào 400 ml dung dịch HCl 1M thu được dung dịch Y. Cho từ từ dung dịch chứa AgNO3 1M vào Y đến các phản ứng hoàn thấy đã dùng 580ml, kết thúc thu được m gam kết tủa và thoát ra 0,448 lít khí (ở đktc). Biết NO là sản phẩm khử duy nhất của N+5 trong cả quá trình, giá trị của m gần nhất với
 Xem đáp án
Xem đáp án
Ta có sơ đồ : 23,76g X + 0,4 mol HCl -> NO + dd Y → 0,02 mol NO + Kết tủa + dd Z
Trong Z có Fe(NO3)3 , Cu(NO3)2
nH+ = 0,4 mol => nNO = ¼ nH+ = 0,1 mol
Trong TN1 : nNO = 0,1 – 0,02 = 0,08 mol
=> Trong X có 0,04 mol Fe(NO3)2 => Trong Z
nNO3 = 0,58 – 0,02 = 0,56 mol
Gọi số mol FeCl2 và Cu trong X lần lượt là a và b
=> 127a + 64b = 16,56g (1)
nNO3 (Z) = (a + 0,04).3 + 2b = 0,56(2)
Từ (1,2) => a = 0,08 ; b = 0,1 mol
Kết tủa thu được gồm :
nAgCl = nCl- = 0,4 + 2.0,08 = 0,56 mol
nAg = 0,08 + 0,1.2 + 0,04 – 0,1.3 = 0,02 mol
=> mkết tủa = 82,52g
Chọn đáp án A.
