Đề thi cuối kì 2 Hóa 12 có đáp án (Đề 13)
-
3809 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Hỗn hợp X gồm hai muối R2CO3và RHCO3. Chia 29,80 gam X thành hai phần bằng nhau:
- Phần một tác dụng hoàn toàn với dung dịch Ba(OH)2dư thu được 35,46 gam kết tủa.
- Phần hai tác dụng hoàn toàn với dung dịch BaCl2dư, thu được 7,88 gam kết tủa.
Phần trăm của muối R2CO3 trong X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Vì chia hỗn hợp X thành 2 phần bằng nhau nên khối lượng mỗi phần là 14,9 gam
Phần 1: có \({n_{CO_3^{2 - }}} + {n_{HCO_3^ - }} = 0,18\,\,mol\)
Phần 2: \({n_{CO_3^{2 - }}} = {n_{BaC{O_3}}} = 0,04\,\,mol\)
\( \to {n_{HCO_3^ - }} = 0,18 - 0,04 = 0,14\,\,mol\)
Ta có: 0,04(R + 60) + 0,14(R + 61) = 14,9
\( \to R = 18(NH_4^ + )\)
\( \to \% {m_{{R_2}C{O_3}}} = \frac{{0,04.96}}{{14,9}}.100\% = 25,77\% \)
Câu 2:
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s1. Số hiệu nguyên tử của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Từ cấu hình electron của X xác định được X có 11 electron.
Số hiệu nguyên tử của X là 11.
Câu 3:
Phương trình hóa học nào sau đây sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cr + H2SO4loãng→ CrSO4+ H2
Câu 4:
Để phân biệt các dung dịch riêng biệt: NaCl, FeCl2, FeCl3, có thể dùng dung dịch
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dùng dung dịch NaOH để phân biệt các dung dịch NaCl, FeCl2, FeCl3:
+ Xuất hiện kết tủa trắng xanh: FeCl2
+ Xuất hiện kết tủa đỏ nâu: FeCl3
+ Không hiện tượng: NaCl
Câu 5:
Hiện tượng xảy ra khi cho từ từ dung dịch NaOH đến dư vào dung dịch AlCl3là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
3NaOH + AlCl3→ Al(OH)3↓ + 3NaCl
NaOH + Al(OH)3→ NaAlO2+ 2H2O
Câu 6:
Để phân biệt các dung dịch loãng: HCl, HNO3, H2SO4có thể dùng thuốc thử nào sau đây ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dùng dung dịch Ba(OH)2cho vào các dung dịch:
+ Xuất hiện kết tủa trắng: H2SO4
+ Không có hiện tượng: HCl, HNO3(nhóm I)
Cho bột đồng kim loại vào 2 dung dịch nhóm I.
+ Xuất hiện khí không màu, hoá nâu ngoài không khí: HNO3
+ Không có hiện tượng: HCl
Câu 7:
Khử hoàn toàn a gam một oxit sắt bằng cacbon oxit ở nhiệt độ cao, người ta thu được 0,84 gam sắt và 0,88 gam khí CO2. Công thức oxit sắt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
\({n_{Fe}} = 0,015\,\,mol;{n_O}_{(oxit)} = {n_{C{O_2}}} = 0,02\,\,mol\)
\( \to \frac{{{n_{Fe}}}}{{{n_O}}} = \frac{{0,015}}{{0,02}} = \frac{3}{4} \to \)oxit sắt là Fe3O4
Câu 8:
Hòa tan hoàn toàn m gam hỗn hợp X gồm FeO, FeCO3và Fe3O4(trong đó Fe3O4chiếm 1/3 tổng số mol hỗn hợp) vào dung dịch HNO3loãng dư, thu được 8,96 lít (đkc) hỗn hợp khí gồm CO2và NO (sản phẩm khử duy nhất của N+5) có tỉ khối so với H2là 18,5. Phần trăm khối lượng của Fe3O4trong X có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Gọi số mol CO2và số mol NO lần lượt là x và y
\( \to \left\{ \begin{array}{l}x + y = 0,4\\\frac{{44x + 30y}}{{x + y}} = 18,5.2\end{array} \right. \to x = y = 0,2\)
\( \to {n_{FeC{O_3}}} = {n_{C{O_2}}} = 0,2\,\,mol\)
Tất cả các chất trong m gam hỗn hợp đều cho đúng 1 electron
→ nX= 3nNO= 0,6 mol
\( \to {n_{F{e_3}{O_4}}} = \frac{1}{3}{n_X} = 0,2\,\,mol \to {n_{FeO}} = 0,2\,\,mol\)
\( \to \% {m_{F{e_3}{O_4}}} = 55,23\% \)
Câu 9:
Để nhận biết ion Ca2+trong dung dịch ta dùng thuốc thử nào sau đây ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Để nhận biết ion Ca2+trong dung dịch ta dùng thuốc thử dung dịch K2CO3.
Ca2++ CO32-→ CaCO3↓
Câu 10:
Nung hỗn hợp X gồm 2,7 gam Al và m gam FeO, sau một thời gian thu được hỗn hợp Y. Để hòa tan hoàn toàn Y cần vừa đủ 300 ml dung dịch H2SO41M. Phần trăm khối lượng của Al trong X là
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Nhận thấy dù tồn tại ở dạng Al hay Al2O3thì đều chỉ tạo muối Al2(SO4)3, tương tự với Fe và FeO đều tạo FeSO4
→ Giả sử xem như không có phản ứng nhiệt nhôm xảy ra
\( \to {n_{{H_2}S{O_4}}} = \frac{3}{2}{n_{Al}} + {n_{FeO}}\)
→ nFeO= 0,15 mol
→ %mAl= 20%
Câu 11:
Kim loại Al không tan được trong dung dịch nào sau đây ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Al không tan được trong dung dịch BaCl2
Câu 12:
Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Ni(NO3)2, AgNO3, H2SO4loãng. Số trường hợp xảy ra phản ứng hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Fe phản ứng với cả 4 dung dịch: FeCl3, Ni(NO3)2, AgNO3, H2SO4loãng
Câu 13:
Cho 6,18 gam hỗn hợp Na2CO3 và KHCO3 vào bình chứa dung dịch Ba(HCO3)2 thu được m kết tủa X và dung dịch Y. Thêm từ từ dung dịch HCl 1,0M vào bình đến khi không còn khí thoát ra thì hết 560 ml. Biết toàn bộ Y phản ứng vừa đủ với 500 ml dung dịch NaOH 1M. Phần trăm khối lượng của K2CO3 trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Đáp án đúng là : D
Gọi số mol Na2CO3, KHCO3và Ba(HCO3)2lần lượt là x, y, z mol
→ 106x + 100y = 6,18 (1)
Khi thêm HCl vào bình, HCl tác dụng với cả kết tủa X và dung dịch Y nên coi như HCl phản ứng với 3 muối ban đầu
→ nHCl= 2x + y + 2z = 0,56 (2)
Phản ứng giữa Na2CO3và Ba(HCO3)2không làm thay đổi lượng \(HCO_3^ - \)
nên nNaOH= y + 2z = 0,5 (3)
Từ (1), (2), (3) → x = y = 0,03 ; z = 0,235
\( \to \% {m_{N{a_2}C{O_3}}} = 51,46\% \)
Câu 14:
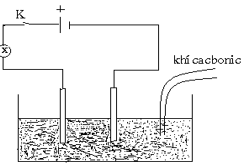
Nước vôi trong Ca(OH)2
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Sục CO2 từ từ đến dư vào Ca(OH)2 thấy xuất hiện kết tủa sau đó kết tủa tan dần.
→ Độ sáng của đèn mờ dần đi rồi sáng dần lên.Câu 15:
Cấu hình electron của Fe là 1s22s22p63s23p63d64s2. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố Fe ở vị trí ô thứ mấy ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Dựa vào cấu hình electron xác định số electron của Fe là 26.
Fe thuộc ô số 26.
Câu 16:
Chất nào sau đây vừa phản ứng được với dung dịch NaOH, vừa phản ứng được với dung dịch HCl?
 Xem đáp án
Xem đáp án
Đáp án đúng là C
Al(OH)3+ 3HCl → AlCl3+ 3H2O
Al(OH)3+ NaOH → NaAlO2+ 2H2O
Câu 17:
Cho các phát biểu sau:
(a) Cr và Cr(OH)3 đều có tính lưỡng tính và tính khử.
(b) Cr2O3và CrO3đều là chất rắn, màu lục, không tan trong nước.
(c) H2CrO4và H2Cr2O7đều chỉ tồn tại trong dung dịch.
(d) CrO3và K2Cr2O7đều có tính oxi hoá mạnh.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là : A
Các phát biểu đúng là: (c), (d)
(a) sai vì Cr không phải là chất lưỡng tính.
(b) sai vì CrO3tan trong nước.
Câu 18:
Cho các phát biểu sau:
(a) Dùng Ba(OH)2có thể phân biệt được hai dung dịch AlCl3và Na2SO4.
(b) Cho dung dịch NaOH vào dung dịch AlCl3dư, thu được kết tủa.
(c) Nhôm là kim loại nhẹ, màu trắng bạc, dẫn điện tốt, dẫn nhiệt tốt.
(d) Kim loại nhôm tan trong dung dịch H2SO4đặc, nguội.
(e) Ở nhiệt độ cao, NaOH và Al(OH)3đều không bị phân hủy.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là : B
Các phát biểu đúng là: (a), (b), (c).
(d) sai vì nhôm không tan trong H2SO4đặc, nguội.
(e) sai vì Al(OH)3bị nhiệt phân hủy.
Câu 19:
Hợp chất Fe2O3tác dụng được với chất nào sau đây ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Fe2O3+ 6HCl → 2FeCl3+ 3H2O
Câu 20:
Chất nào sau đây làm mất tính cứng của nước cứng tạm thời?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Na2CO3làm mất tính cứng của nước cứng tạm thời.
Ca2++ CO32-→ CaCO3↓
Mg2++ CO32-→ MgCO3↓
Câu 21:
Kim loại nào sau đây tan được trong nước ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
2K + 2H2O → 2KOH + H2
Câu 22:
Cho dung dịch muối AgNO3đến dư vào dung dịch muối FeCl2, thu được kết tủa X. Cho X vào dung dịch HNO3(loãng, dư), thu được chất rắn T và khí không màu hóa nâu trong không khí. T là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 23:
Thí nghiệm nào sau đây không xảy ra phản ứng hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Al không phản ứng được với MgCl2
Câu 24:
Số oxi hóa của Cr trong hợp chất K2Cr2O7là
 Xem đáp án
Xem đáp án
Đáp án đúng là : A
Số oxi hoá của Cr trong hợp chất K2Cr2O7là +6.
Câu 25:
Hòa tan hoàn toàn 13,8 gam hỗn hợp X gồm Al, Fe vào dung dịch H2SO4loãng, thu được 10,08 lít khí (đktc). Phần trăm về khối lượng của Al trong X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Gọi số mol Al và Fe lần lượt là x và y mol
\( \to \left\{ \begin{array}{l}{m_{hh}} = 27x + 56y = 13,8\\BTE:3x + 2y = 2.0,45\end{array} \right. \to \left\{ \begin{array}{l}x = 0,2\\y = 0,15\end{array} \right.\)
→ %mAl= 39,13%
Câu 26:
Các dung dịch Na2SO4và Al2(SO4)3đều không màu. Để phân biệt 2 dung dịch này có thể dùng dung dịch của chất nào sau đây ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cho từ từ dung dịch NaOH vào 2 dung dịch cần phân biệt:
+ Không có hiện tượng: Na2SO4
+ Xuất hiện kết tủa sau đó kết tủa tan: Al2(SO4)3
Câu 27:
Để hoà tan hoàn toàn 22,80 gam FeSO4cần vừa đủ V ml dung dịch K2Cr2O70,2M trong H2SO4loãng, dư. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
K2Cr2O7+ 6FeSO4+ 7H2SO4→ 3Fe2(SO4)3+ Cr2(SO4)3+ K2SO4+ 7H2O
0,025 → 0,15mol
→ V = 0,125 lít = 125 ml
Câu 28:
Cho bột Fe vào dung dịch hỗn hợp NaNO3và HCl đến khi các phản ứng kết thúc, thu được dung dịch X, hỗn hợp khí NO, H2và chất rắn không tan. Các muối trong dung dịch X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Chất rắn không tan là Fe dư → không thể còn muối sắt (III) → loại C và D
Do có H2nên NO3-hết → loại A.
→ Các muối trong dung dịch X là NaCl và FeCl2
Câu 29:
Dãy các chất đều tác dụng được với dung dịch Ca(OH)2 là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Loại A, C, D do NaCl, Na2SO4, BaCl2, KNO3không tác dụng được với dung dịch Ca(OH)2
Câu 30:
Có thể điều chế Na, Mg, Ca bằng cách nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Na, Mg, Ca đều là các kim loại hoạt động hóa học mạnh.
Có thể điều chế Na, Mg, Ca bằng cách điện phân nóng chảy muối clorua.
