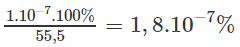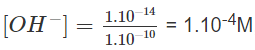Giải SBT Hóa học 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
-
75 lượt thi
-
10 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Giá trị tích số ion của nước phụ thuộc vào :
A. áp suất.
B. nhiệt độ.
C. sự có mặt của axit hoà tan.
D. sự có mặt của bazơ hoà tan.
 Xem đáp án
Xem đáp án
Chọn đáp án B
Tích số ion của nước = [OH-].[H+]. Tích số này là hẳng số ở nhiệt độ xác định, tuy nhiên giá trị tích số ion của nước là 1,0.10-14 thường được dùng trong các pháp tính, khi nhiệt độ không khác nhiều với 25oC
Câu 2:
Hoà tan một axit vào nước ở , kết quả là
A. [] < [].
B. [] = [].
C. [] > [].
D. [][] > 1..
 Xem đáp án
Xem đáp án
Chọn đáp án C
Khi hòa tan axit vào nước, dung dịch thu được có môi trường axit nên [H+] > [OH-]
Câu 3:
Dung dịch của một bazơ ở có :
A. [] = 1.M.
B. [] < 1.M.
C. [] > 1.M.
D. [][OH-] > .
 Xem đáp án
Xem đáp án
Chọn đáp án B
Môi trường trung tính: [H+].[OH-] = 1,0.10-14
Môi trường axit [H+] > 1,0.10-7M (hay pH < 7)
Môi trường bazơ [H+] < 1.10-7M (hay pH > 7)
Câu 4:
Cho các dung dịch , KCl, , , , . Có bao nhiêu dung dịch có pH > 7?
A. 1 B. 2
C. 3 D. 4
 Xem đáp án
Xem đáp án
Đáp án: C.
Câu 5:
Tích số ion của nước ở một số nhiệt độ như sau:
Ở : = 7.
Ở : = 1..
Ở : = 1,5..
Hỏi sự điện li của nước là thu nhiệt hay toả nhiệt ?
 Xem đáp án
Xem đáp án
Thu nhiệt, vì khi nhiệt độ tăng tích số ion của nước tăng, nghĩa là sự điện li của nước tăng, tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê.
Câu 7:
Nước nguyên chất ở có nồng độ bằng 1. mol/l. Hỏi có bao nhiêu phần trăm phân tử phân li ra ion ở nhiệt độ này, biết rằng = 1 ?
 Xem đáp án
Xem đáp án
1 lít nước nặng 1000 g, nên số mol nước trong 1000 g là 55,5 mol.
Cứ có 55,5 mol nước ở thì có 1.mol phân li ra ion. Phần trăm mol nước phân li ra ion :
1,8.% mol phân li ra ion cũng là phần trăm số phân tử phân li ra ion.
Câu 8:
Có 250 ml dung dịch HCl 0,4M. Hỏi phải thêm bao nhiêu nước vào dung dịch này để được dung dịch có pH = 1,00 ? Biết rằng sự biến đổi thể tích khi pha trộn là không đáng kể.
 Xem đáp án
Xem đáp án
Để có pH = 1 thì nồng độ HCl phải bằng 1. mol/l. Vậy phải pha loãng 4 lần dung dịch HCl 0,4M, nghĩa là pha thêm 750 ml nước.
Câu 9:
Cần bao nhiêu gam NaOH để pha chế 250 ml dung dịch có pH = 10 ?
 Xem đáp án
Xem đáp án
Khi pH = 10 thì [H+] = 1.10-10M và
nghĩa là cần có 1. mol NaOH trong 1 lít dung dịch.
Vậy trong 250 ml (0,25 lít) dung dịch cần có 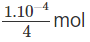
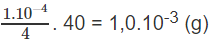
Câu 10:
Chỉ dùng thuốc thử phenophtalein, hãy trình bày cách phân biệt ba dung dịch cùng nồng độ mol sau: KOH, và .
 Xem đáp án
Xem đáp án
- Nhỏ vài giọt dung dịch phenolphtalein vào cả ba dung dịch. Dung dịch nào có màu hồng là dung dịch KOH.
- Lấy các thể tích bằng nhau của ba dung dịch : V ml dung dịch KOH và V ml của mỗi dung dịch axit. Thêm vào hai dung dịch axit vài giọt dung dịch phenolphtalein. Đổ V ml dung dịch KOH vào từng V ml dung dịch axit, sau đó thêm một ít dung dịch KOH nữa, nếu có màu hồng thì dung dịch axit đó là , ngược lại nếu không có màu hồng là dung dịch .