Giải SGK Hóa 11 Cánh diều Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base có đáp an
Giải SGK Hóa 11 Cánh diều Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base có đáp an
-
155 lượt thi
-
13 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
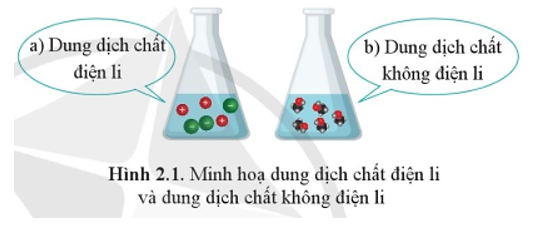
Quan sát Hình 2.1, em hãy nêu những sự khác nhau giữa chất điện li và chất không điện li.
 Xem đáp án
Xem đáp án
Sự khác nhau giữa chất điện li và chất không điện li:
+ Chất điện li là chất khi tan trong nước phân li thành ion.
+ Chất không điện li là chất khi tan trong nước không phân li thành ion.
Câu 2:
Trong thí nghiệm trên, đèn sáng hay không sáng chứng tỏ tính chất vật lí nào của dung dịch chất tan?
 Xem đáp án
Xem đáp án
Trong thí nghiệm, đèn sáng hay không sáng chứng tỏ tính dẫn điện của dung dịch chất tan.
+ Đèn sáng chứng tỏ dung dịch chất tan dẫn điện.
+ Đèn không sáng chứng tỏ dung dịch chất tan không dẫn điện.
Câu 3:
Dự đoán trong thí nghiệm trên, cốc thuỷ tinh chứa nước nguyên chất thì đèn sáng hay không.
 Xem đáp án
Xem đáp án
Dự đoán trong thí nghiệm trên, cốc thuỷ tinh chứa nước nguyên chất thì đèn không sáng.
Do nước nguyên chất không dẫn điện.
Câu 4:
Tìm hiểu và cho biết những chất nào sau đây thuộc loại chất điện li: HCl, Fe, BaCl2, Ca(OH)2, CH3COOH, O2.
 Xem đáp án
Xem đáp án
Chất điện li là chất khi tan trong nước phân li thành ion.
Vậy những chất thuộc loại chất điện li là: HCl, BaCl2, Ca(OH)2, CH3COOH.
Câu 5:
Ở quá trình (3b), nước đóng vai trò là acid hay base? Vì sao?
 Xem đáp án
Xem đáp án
Quá trình (3b): HCl + H2O → H3O+ + Cl-
Trong quá trình này nước đóng vai trò là base do nhận H+.
H2O + H+ → H3O+.
Câu 6:
Trong cân bằng (4), hãy chỉ ra hai acid và hai base. Giải thích.
 Xem đáp án
Xem đáp án
Cân bằng (4): NH3+ H2O⇌ NH+4+ OH−
Trong phản ứng thuận của (4), H2O đã nhường H+ cho NH3 nên đóng vai trò là acid, còn NH3 nhận H+ từ H2O nên đóng vai trò là base.
Trong phản ứng nghịch của (4), NH4+ đã nhường H+ cho OH- nên đóng vai trò là acid, còn OH- nhận H+ từ NH4+ nên đóng vai trò là base.
Vậy trong cân bằng (4):
+ Hai acid là: H2O và NH4+.
+ Hai base là: NH3 và OH-.
Câu 7:
Dựa vào cân bằng (4) và (5), hãy giải thích vì sao H2O được cho là chất có tính lưỡng tính (là chất vừa có tính acid, vừa có tính base).
 Xem đáp án
Xem đáp án
Nước được cho là chất có tính lưỡng tính (là chất vừa có tính acid, vừa có tính base) do nước vừa có khả năng nhường H+ (cân bằng 4) vừa có khả năng nhận H+ (cân bằng 5).
Câu 8:
Cho các phân tử sau: HBr, HI, H2S, KOH. Hãy phân loại chúng thành acid mạnh, base mạnh, acid yếu và base yếu.
 Xem đáp án
Xem đáp án
Acid mạnh và base mạnh phân li hoàn toàn trong nước; Acid yếu và base yếu phân li một phần trong nước. Vậy:
+ Acid mạnh là: HBr và HI
HBr → H+ + Br-
HI → H+ + I-
+ Base mạnh là: KOH
KOH → K+ + OH-
+ Acid yếu là: H2S
H2S ⇌ H+ + HS-
(HS- ⇌ H+ + S2-)
Câu 9:
Trong các cân bằng (7), (8a) và (8b), xác định các acid và base.
 Xem đáp án
Xem đáp án
+ Cân bằng (7): Al3+ + 3H2O ⇌ Al(OH)3 + 3H+
Trong cân bằng (7) Al3+ đóng vai trò là acid; H2O đóng vai trò là base.
+ Cân bằng (8a): CO2−3+H2O⇌HCO−3+OH−
Trong cân bằng (8a) H2O đóng vai trò là acid, CO32- đóng vai trò là base.
+ Cân bằng (8b): HCO−3+H2O⇌H2CO3+OH−
Trong cân bằng (8b) H2O đóng vai trò là acid, HCO3- đóng vai trò là base.
Câu 10:
Tương tự Ví dụ 5, hãy cho biết dung dịch phèn sắt (NH4Fe(SO4)2.12H2O) có môi trường acid hay base. Giải thích. Vì sao người ta có thể dùng phèn sắt để loại bỏ các chất lơ lửng trong nước?
 Xem đáp án
Xem đáp án
- Dung dịch phèn sắt (NH4Fe(SO4)2.12H2O) có môi trường acid. Do trong nước, phèn sắt bị phân li hoàn toàn theo phương trình:
NH4Fe(SO4)2.12H2O → NH4+ + Fe3+ + 2SO42- + 12H2O
Ion NH4+ và Fe3+ đóng vai trò là acid trong các cân bằng:
NH4+ + H2O ⇌ NH3 + H3O+ (*)
Fe3+ + 3H2O ⇌ Fe(OH)3 + 3H+ (**)
- Người ta có thể dùng phèn sắt để loại bỏ các chất lơ lửng trong nước bởi ion Fe3+ tạo Fe(OH)3 theo (**) ở dạng kết tủa, có khả năng hấp phụ các chất rồi lắng xuống đáy bể.
Câu 11:
Nếu dòng điện chạy qua được dung dịch nước của một chất X, những phát biểu nào sau đây là không đúng?
a) Chất X là chất điện li.
b) Trong dung dịch chất X có các ion dương và ion âm.
c) Chất X ở trạng thái rắn khan cũng dẫn điện.
d) Trong dung dịch chất X có electron tự do.
 Xem đáp án
Xem đáp án
Đáp án đúng là: (c); (d)
Phát biểu (c) không đúng do X ở trạng thái rắn, khan không dẫn điện.
Phát biểu (d) không đúng do dung dịch chất X có các ion dương và ion âm.
Câu 12:
Giải thích vì sao dung dịch HCl dẫn điện tốt hơn dung dịch CH3COOH có cùng nồng độ.
 Xem đáp án
Xem đáp án
Giả sử nồng độ của dung dịch HCl bằng nồng độ của dung dịch CH3COOH và bằng x M.
HCl là acid mạnh, phân li hoàn toàn trong nước:
HCl → H+ + Cl-
x → x x M
CH3COOH là acid yếu, phân li một phần trong nước:
CH3COOH ⇌ CH3COO- + H+
x M
Suy ra [CH3COO-] = [H+] < x M
Vậy dung dịch HCl dẫn điện tốt hơn dung dịch CH3COOH có cùng nồng độ do trong dung dịch HCl (x M) có nhiều phần tử mang điện hơn dung dịch CH3COOH (x M).
Câu 13:
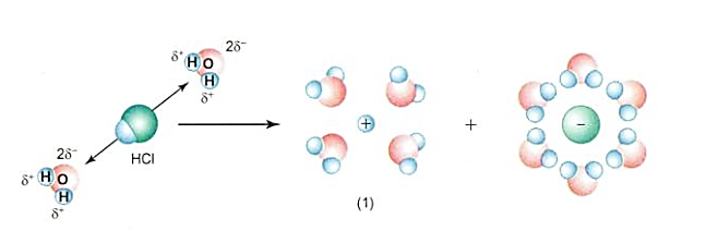
Giải thích vai trò của nước trong sự điện li của HCl và NaOH.
 Xem đáp án
Xem đáp án
Nước là dung môi phân cực, đóng vai trò quan trọng trong sự điện li của HCl và NaOH.
+ Khi tan trong nước, các phân tử HCl hút về chúng những cực ngược dấu của các phân tử nước. Do sự tương tác giữa các phân tử nước và phân tử HCl, kết hợp với sự chuyển động không ngừng của các phân tử nước dẫn đến sự điện li phân tử HCl ra các ion H+ và Cl-.
+ NaOH là hợp chất ion, trong tinh thể có các ion Na+ và OH- liên kết với nhau bằng lực hút tĩnh điện. Nước là dung môi phân cực. Khi cho tinh thể NaOH vào nước, các ion Na+ và OH- trên bề mặt hút các phân tử nước lại gần. Các phân tử nước hướng các đầu âm vào ion Na+, các đầu dương vào ion OH- làm yếu liên kết giữa các cation, anion trong tinh thể và khuếch tán vào nước.
