Bài 27 : Luyện tập : Ankan và xicloankan
-
619 lượt thi
-
6 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 2:
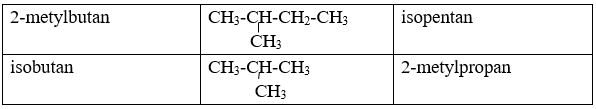
Ankan Y mạch không nhánh có công thức đơn giản nhất là C2H5
a. Tìm công thức phân tử, viết công thức cấu tạo và gọi tên chất Y.
b. Viết phương trình hóa học phản ứng của Y với clo khi chiếu sáng, chỉ rõ sản phẩm chính của phản ứng.
 Xem đáp án
Xem đáp án
a. Gọi CTPT của ankan Y là CnH2n+2(n ≥ 1)
CTĐGN của Y là C2H5, nên gọi CTCT của Y là : (C2H5)x (x ≥ 1)
CTCT của Y là: CH3-CH2-CH2-CH3: butan
Câu 3:
Đốt cháy hoàn toàn 3,36,lít hỗn hợp khí A gồm metan và etan thu được 4,48 lít khí cacbonic. Các thể khí được đo ở điều kiện tiêu chuẩn. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A.
 Xem đáp án
Xem đáp án
Gọi số mol của metan và etan lần lượt là x và y (mol)
Phương trình phản ứng:
Vậy thành phần phần trăm về thể tích các khí trong hỗn hợp A là:
Câu 4:
Khi 1,00 g metan cháy tỏa ra 55,6 kJ. Cần đốt bao nhêu lít khí metan (đktc) để lượng nhiệt sinh ra đủ đun 1,00 lít nước (D = 1,00 g/cm3) từ 25,0oC lên 100,0oC. Biết rằng muốn nâng 1,00g nước lên 1,0oC cần tiêu tốn 4,18J và giả sử nhiệt sinh ra chỉ dùng để làm tăng nhiệt độ của nước.
 Xem đáp án
Xem đáp án
Khối lượng của 1,00 lit nước là:
m = D.V = 1,00.1000 = 1000g
Nhiệt lượng mà 1000 gam nước thu vào để tăng nhiệt độ từ 25oC đến 100oC là:
Q = 1000.4,18(100 - 25) = 313500(J) = 313,5 KJ
Đó là nhiệt lượng mà khí metan khi đốt cháy cần phải toả ra.
Khối lượng metan cần phải đốt cháy là:
Số mol metan cần phải đốt cháy là:
Vậy thể tích khí metan (đktc) cần phải đốt cháy là:
Câu 5:
Khi cho pentan tác dụng với brom theo tỉ lệ 1:1, sản phẩm chính thu được là:
Hãy chọn đáp án đúng
 Xem đáp án
Xem đáp án
Đáp án A
Sản phẩm chính khi cho pentan tác dụng với brom theo tỉ lệ 1:1 là:
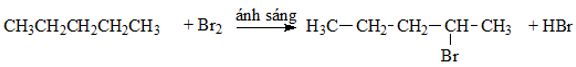
Câu 6:
Đánh dấu Đ (đúng) hoặc S (sai) vào các ô trống cạnh các câu sau đây:
a. Ankan là hidrocacbon no, mạch hở.
b. Ankan có thể bị tách hidro thành anken.
c. Crăckinh ankan thu được hỗn hợp các ankan.
d. Phản ứng của clo với ankan tạo thành ankyl clorua thuộc loại phản ứng thế.
e. Ankan có nhiều trong dầu mỏ.
 Xem đáp án
Xem đáp án
a. Đ
b. Đ
c. S
d. Đ
e. Đ