Giải SGK Hoá học 11 Kết nối tri thức Bài 16: Hydrocarbon không no có đáp án
Giải SGK Hoá học 11 Kết nối tri thức Bài 16: Hydrocarbon không no có đáp án
-
303 lượt thi
-
13 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Sự ra đời của hoá học alkene khoảng giữa thế kỉ XX là một dấu mốc quan trọng tạo nên bước đột phá cho sự phát triển mạnh mẽ của công nghiệp hoá học hữu cơ.
Vậy, alkene, alkyne có vai trò quan trọng thế nào trong hoá học nói chung và hoá hữu cơ nói riêng?
 Xem đáp án
Xem đáp án
Alkene, alkyne đóng vai trò quan trọng trong hoá học nói chung và hoá hữu cơ nói riêng.
Alkene là nguyên liệu để tổng hợp một số polymer như polyethylene (PE); polypropylene (PP) … đây là các polymer được dùng để làm bao bì và các đồ dùng như li, cốc, tủ chứa đồ …Trong công nghiệp dược phẩm, các alkyne là nguyên liệu sản xuất một số dược phẩm như thuốc kháng vius Efavirenz, thuốc kháng nấm Terbinafine, …
Alkyne được dùng làm nguyên liệu trong tổng hợp hữu cơ. Ví dụ acetylene là một alkyne được dùng để tổng hợp các vật liệu polymer như poly(vinyl alcohol), poly(vinyl acetate), … dùng làm bao bì, keo dán, màng đệm, …
Câu 2:
Em hãy viết công thức electron, công thức Lewis của các hydrocarbon sau: C2H6, C2H4, C2H2. Nhận xét sự khác nhau về đặc điểm liên kết trong phân tử của ba hydrocarbon trên.
 Xem đáp án
Xem đáp án
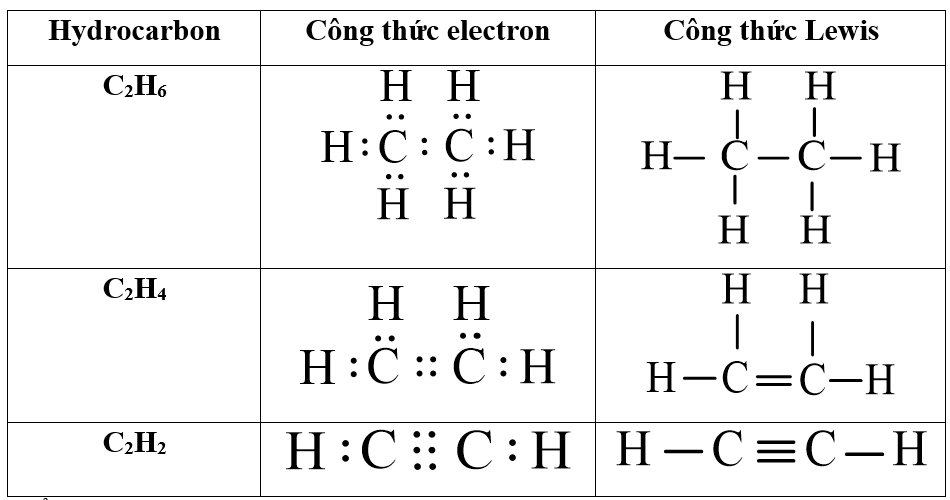
Điểm khác nhau:
Trong phân tử C2H6 chỉ chứa liên kết đơn;
Trong phân tử C2H4 có chứa liên kết đôi C = C;
Trong phân tử C2H2 có chứa liên kết ba C ≡ C.
Câu 3:
Điều kiện để có đồng phân hình học của alkene 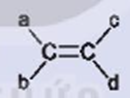 là gì?
là gì?
 Xem đáp án
Xem đáp án
Trong phân tử alkene nếu mỗi nguyên tử carbon của liên kết đôi liên kết với hai nguyên tử hoặc hai nhóm nguyên tử khác nhau thì sẽ có đồng phân hình học.
Vậy điều kiện để có đồng phân hình học của alkene 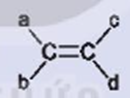 là:
là:
a ≠ b và c ≠ d.
Câu 4:
Alkene 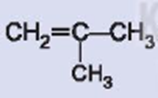 có đồng phân hình học không? Giải thích.
có đồng phân hình học không? Giải thích.
 Xem đáp án
Xem đáp án
Alkene này không có đồng phân hình học do một nguyên tử carbon của liên kết đôi liên kết với hai nguyên tử giống nhau (- H) và nguyên tử C còn lại của liên kết đôi liên kết với hai nhóm nguyên tử giống nhau (- CH3).
Câu 5:
Viết các công thức cấu tạo và gọi tên theo danh pháp thay thế của các alkene và alkyne có công thức phân tử C5H10, C5H8.
 Xem đáp án
Xem đáp án
- Các công thức cấu tạo của alkene có công thức phân tử C5H10:
CH2 = CH – CH2 – CH2 – CH3: pent – 1 – ene;
CH3 – CH = CH – CH2 – CH3: pent – 2 – ene;
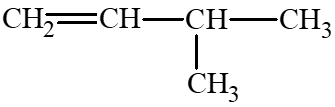 : 3 – methylbut – 1 – ene;
: 3 – methylbut – 1 – ene;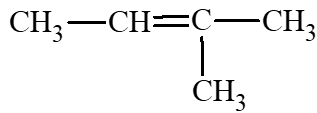 : 2 – methylbut – 2 – ene;
: 2 – methylbut – 2 – ene;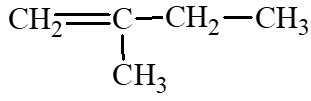 : 2 – methylbut – 1 – ene.
: 2 – methylbut – 1 – ene.- Các công thức cấu tạo của alkyne có công thức phân tử C5H8:
CH ≡ C – CH2 – CH2 – CH3: pent – 1 – yne;
CH3 – C ≡ C – CH2 – CH3: pent – 2 – yne;
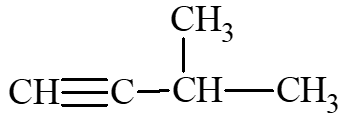 : 3 – methylbut – 1 – yne.
: 3 – methylbut – 1 – yne.Câu 6:
Trong các chất sau, chất nào có đồng phân hình học?

 Xem đáp án
Xem đáp án
Trong phân tử alkene nếu mỗi nguyên tử carbon của liên kết đôi liên kết với hai nguyên tử hoặc hai nhóm nguyên tử khác nhau thì sẽ có đồng phân hình học.
Vậy trong số bốn chất, chỉ có chất (b) có đồng phân hình học.
Câu 7:
Viết phương trình hoá học của các phản ứng:
a) Propene tác dụng với hydrogen, xúc tác nickel.
b) Propene tác dụng với nước, xúc tác H3PO4.
c) 2 – methylpropene tác dụng với nước, xúc tác acid H3PO4.
d) But – 1 – ene tác dụng với HCl.
 Xem đáp án
Xem đáp án
a) CH2 = CH – CH3 + H2 CH3 – CH2 – CH3;
b) CH2 = CH – CH3 + H2O ;
c) 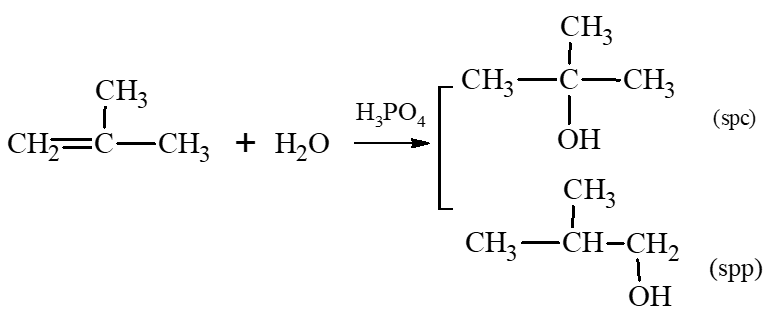
Câu 8:
Trong các chất sau, những chất nào làm mất màu nước bromine: propane, propene, propyne, 2 – methylpropene?
 Xem đáp án
Xem đáp án
Các hydrocarbon trong phân tử có liên kết ℼ làm mất màu nước bromine.
Vậy các chất làm mất màu nước bromine là: propene, propyne, 2 – methylpropene.
Câu 9:
Chuẩn bị: cồn 96o, dung dịch sulfuric acid đặc, đá bọt; bình cầu có nhánh 250 mL, ống nghiệm (1) chứa khoảng 2 mL dung dịch KMnO4 loãng, ống nghiệm (2) chứa khoảng 2 mL nước Br2 loãng, ống dẫn thuỷ tinh hình chữ L, ống dẫn thuỷ tinh đầu vuốt nhọn, giá để ống nghiệm, nguồn nhiệt, que đóm, lưới tản nhiệt, bình thuỷ tinh chứa dung dịch NaOH.
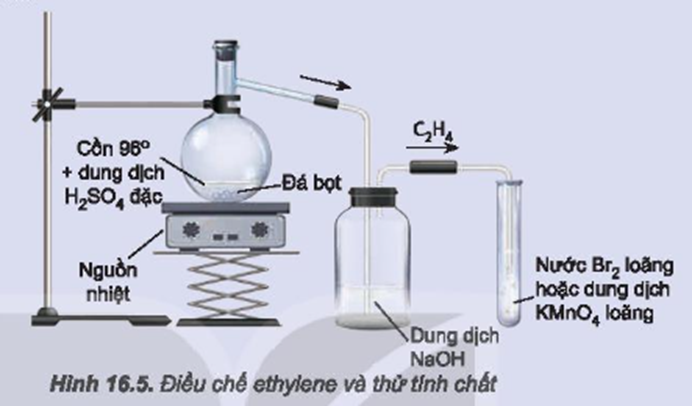
Tiến hành:
- Cho vài viên đá bọt, 20 mL cồn 96° vào bình cầu. Rót 40 mL dung dịch H2SO4 đặc vào ống đong, sau đó rót từ từ H2SO4 đặc từ ống đong qua phễu vào bình cầu để tránh sự toả nhiệt quá mạnh.
- Lắp bộ dụng cụ như Hình 16.5.
- Đun nóng đến khi ethylene sinh ra và sục ngay vào các ống nghiệm (1) và (2).
- Thay ống dẫn khí thuỷ tinh hình chữ L bằng ống dẫn thuỷ tinh có đầu vuốt nhọn.
Dùng que đóm đang cháy để đốt ethylene ở đầu ống dẫn khí.
Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cẩn thận khi sử dụng.
Hãy giải thích hiện tượng và viết phương trình hoá học của phản ứng xảy ra.
 Xem đáp án
Xem đáp án
Đun cồn 96o với sulfuric acid đặc sinh ra khí ethylene (có lẫn tạp chất như CO2, SO2…).
Khí sinh ra được dẫn qua bình (1) để loại tạp chất; dẫn tiếp qua bình (2) thấy dung dịch Br2 (hoặc dung dịch KMnO4) nhạt dần đến mất màu do liên kết pi ở liên kết đôi của ethylene kém bền vững.
Đốt ethylene ở đầu ống dẫn khí, khí ethylene cháy và toả nhiều nhiệt.
Phương trình hoá học:
C2H5OH CH2 = CH2 + H2O
CH2 = CH2 + Br2 → CH2Br – CH2Br
3CH2 = CH2 + 2KMnO4 + 4H2O → 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH
C2H4 + 3O2 2CO2 + 2H2O.
Câu 10:
Chuẩn bị: đất đèn (chứa CaC2), nước tinh khiết; ống nghiệm chứa khoảng 2 mL dung dịch KMnO4 loãng, ống nghiệm chứa khoảng 2 mL dung dịch nước Br2 loãng, bình cầu có nhánh 250 mL, ống dẫn thuỷ tinh hình chữ L, ống dẫn thuỷ tinh đầu vuốt nhọn, giá để ống nghiệm, que đóm, bình thuỷ tinh chứa dung dịch NaOH.
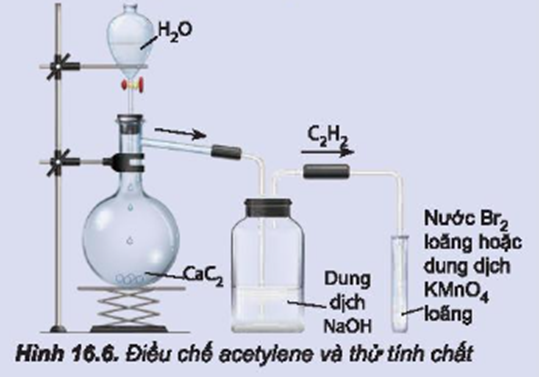
Tiến hành:
- Cho khoảng 5 g đất đèn vào bình cầu có nhánh và cho nước cất vào phễu nhỏ giọt. Lắp dụng cụ như Hình 16.6 (chú ý đuôi của phễu nhỏ giọt không chạm vào chất rắn).
- Mở khoá phễu nhỏ giọt để nước chảy từ từ xuống, khí acetylene sinh ra được sục ngay vào các ống nghiệm chứa dung dịch KMnO4 và nước Br2 đã chuẩn bị ở trên đến khi dung dịch mất màu.
- Thay ống dẫn khí thuỷ tinh hình chữ L bằng ống dẫn thuỷ tinh có đầu vuốt nhọn. Dùng que đóm đang cháy để đốt acetylene sinh ra ở đầu ống dẫn khí.
Hãy giải thích hiện tượng và viết phương trình hoá học của các phản ứng xảy ra.
 Xem đáp án
Xem đáp án
Đất đèn (thành phần chính CaC2) tác dụng với nước sinh ra khí acetylene (C2H2).
Khí này có thể lẫn tạp chất nên được dẫn qua bình (1) chứa NaOH để tinh chế.
Dẫn acetylene vào các ống nghiệm chứa dung dịch KMnO4 và nước Br2 thấy các dung dịch này nhạt dần đến mất màu do liên kết pi ở acetylene kém bền vững.
Khi đốt acetylene cháy, toả nhiều nhiệt.
Phương trình hoá học minh hoạ:
CaC2 + 2H2O → Ca(OH)2 + C2H2
CH ≡ CH + 2Br2 → CHBr2 – CHBr2
3CH ≡ CH + 8KMnO4 → 3KOOC – COOK + 8MnO2 + 2KOH + 2H2O
Câu 11:
Hãy trình bày phương pháp hoá học nhận biết ba khí sau: ethane, ethylene, acetylene.
 Xem đáp án
Xem đáp án
Cho lần lượt từng khí tác dụng với dung dịch bromine:
+ Dung dịch bromine bị nhạt dần đến mất màu → ethylene, acetylene (nhóm I).
CH2 = CH2 + Br2 → CH2Br – CH2Br
CH ≡ CH + 2Br2 → CHBr2 – CHBr2
+ Dung dịch bromine không bị mất màu → ethane.
Cho các khí ở nhóm I tác dụng với AgNO3 trong NH3:
+ Xuất hiện kết tủa màu vàng nhạt → acetylene.
HC ≡ CH + 2AgNO3 + 2NH3 → Ag – C ≡ C – Ag (vàng nhạt) + 2NH4NO3
+ Không có hiện tượng → ethylene.
Câu 12:
Viết phương trình hoá học của các phản ứng:
a) Propene tác dụng với dung dịch KMnO4.
b) Propyne tác dụng với dung dịch AgNO3/NH3.
 Xem đáp án
Xem đáp án
a) 3CH2 = CH – CH3 + 2KMnO4 + 4H2O → 3CH2OH – CH(OH) – CH3 + 2MnO2 + 2KOH
b) CH ≡ C – CH3 + AgNO3 + NH3 → CAg ≡ C – CH3 + NH4NO3.
Câu 13:
Vận dụng các kiến thức về alkene, alkyne để giải thích được các vai trò quan trọng của alkene và alkyne trong công nghiệp hoá học, công nghiệp dược phẩm, vật liệu, …
 Xem đáp án
Xem đáp án
Alkene, alkyne đóng vai trò quan trọng trong hoá học nói chung và hoá hữu cơ nói riêng.
Alkene là nguyên liệu để tổng hợp một số polymer như polyethylene (PE); polypropylene (PP) … đây là các polymer được dùng để làm bao bì và các đồ dùng như li, cốc, tủ chứa đồ … Trong công nghiệp dược phẩm, các alkyne là nguyên liệu sản xuất một số dược phẩm như thuốc kháng vius Efavirenz, thuốc kháng nấm Terbinafine, …
Alkyne được dùng làm nguyên liệu trong tổng hợp hữu cơ. Ví dụ acetylene là một alkyne được dùng để tổng hợp các vật liệu polymer như poly(vinyl alcohol), poly(vinyl acetate), … dùng làm bao bì, keo dán, màng đệm, …
