Giải SGK Hoá học 11 Kết nối tri thức Bài 8: Sulfuric acid và muối sulfate có đáp án
Giải SGK Hoá học 11 Kết nối tri thức Bài 8: Sulfuric acid và muối sulfate có đáp án
-
72 lượt thi
-
15 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Sulfuric acid là hoá chất quan trọng hàng đầu trong công nghiệp, được sử dụng cả ở dạng dung dịch loãng và dạng dung dịch đặc dựa trên những tính chất khác biệt.
Vậy, dung dịch sulfuric acid loãng và dung dịch sulfuric acid đặc có những tính chất quan trọng nào? Cần lưu ý điều gì khi bảo quản và sử dụng acid này để đảm bảo an toàn?
 Xem đáp án
Xem đáp án
- Tính chất của sulfuric acid loãng:
Dung dịch sulfuric acid loãng có đầy đủ tính chất của một acid mạnh:
+ Đổi màu quỳ tím thành đỏ.
+ Tác dụng với kim loại hoạt động trong dãy hoạt động hoá học.
+ Tác dụng với basic oxide và base.
+ Tác dụng với nhiều muối.
- Tính chất của sulfuric acid đặc: Ngoài tính acid, dung dịch sulfuric acid đặc còn có tính oxi hoá và tính háo nước.
- Cách bảo quản sulfuric acid:
+ Sulfuric acid được bảo quản trong chai, lọ có nút đậy chặt, đặt ở vị trí chắc chắn.
+ Đặt chai, lọ đựng dung dịch sulfuric acid đặc tránh xa các lọ chứa chất dễ gây cháy, nổ như chlorate, perchlorate, permanganate, dichromate.
- Cách sử dụng sulfuric acid để đảm bảo an toàn:
Sulfuric acid gây bỏng khi rơi vào da, do vậy cần tuân thủ các nguyên tắc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đổ nước vào dung dịch acid đặc.
Câu 2:
a) Dựa vào cấu tạo, cho biết phân tử sulfuric acid có khả năng cho bao nhiêu proton khi đóng vai trò là acid.
 Xem đáp án
Xem đáp án
a) Công thức cấu tạo của sulfuric acid:
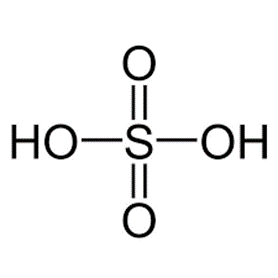
Như vậy, phân tử sulfuric acid có khả năng cho 2 proton khi đóng vai trò là acid.
Câu 3:
b) Dựa vào tương tác giữa các phân tử, hãy dự đoán sulfuric acid là chất lỏng dễ bay hơi hay khó bay hơi.
 Xem đáp án
Xem đáp án
b) Với cấu tạo gồm các nguyên tử hydrogen linh động và các nguyên tử oxygen có độ âm điện lớn, giữa các phân tử sulfuric acid hình thành nhiều liên kết hydrogen:
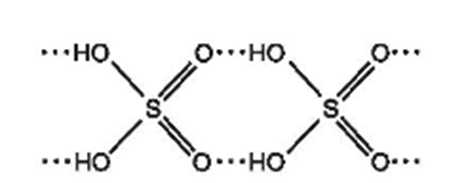
Dự đoán sulfuric acid là chất lỏng khó bay hơi.
Câu 4:
a) Nêu các lưu ý bắt buộc để đảm bảo an toàn khi sử dụng dung dịch sulfuric acid đặc.
b) Hãy cho biết ý nghĩa cảnh báo của kí hiệu cảnh báo ở Hình 8.3.

 Xem đáp án
Xem đáp án
a) Các lưu ý bắt buộc để đảm bảo an toàn khi sử dụng dung dịch sulfuric acid đặc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đổ nước vào dung dịch acid đặc.
b) Kí hiệu cảnh báo ở Hình 8.3 có ý nghĩa đây là hoá chất ăn mòn.
Câu 5:
Em hãy cho biết các tính chất hoá học cơ bản của một acid.
 Xem đáp án
Xem đáp án
Các tính chất hoá học cơ bản của một acid:
+ Đổi màu quỳ tím thành đỏ.
+ Tác dụng với kim loại hoạt động trong dãy hoạt động hoá học.
+ Tác dụng với basic oxide và base.
+ Tác dụng với nhiều muối.
Câu 6:
Viết phương trình hoá học minh hoạ tính acid của dung dịch H2SO4 loãng với: kim loại Fe, bột MgO, dung dịch Na2CO3, dung dịch BaCl2.
 Xem đáp án
Xem đáp án
Các phương trình hoá học minh hoạ:
H2SO4 (loãng) + Fe → FeSO4 + H2
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
H2SO4 + BaCl2 → BaSO4 + 2HCl.
Câu 7:
Chuẩn bị: đồng lá hoặc phoi bào, dung dịch sulfuric acid 70%; ống nghiệm, kẹp gỗ, đèn cồn, bông tẩm dung dịch NaOH loãng.
Tiến hành:
- Cho vài lá đồng đã cắt nhỏ vào ống nghiệm, thêm tiếp khoảng 3 mL dung dịch H2SO4 70%, dùng bông đã tẩm dung dịch NaOH loãng nút miệng ống nghiệm.
- Hơ nóng đều phần ống nghiệm chứa dung dịch trên ngọn lửa đèn cồn, sau đó đun tập trung vào đáy ống nghiệm.
Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cẩn thận khi sử dụng.
Quan sát, mô tả hiện tượng xảy ra và thực hiện yêu cầu sau:
1. Viết phương trình hoá học của phản ứng và xác định chất oxi hoá, chất khử.
2. Nhận xét về khả năng phản ứng của dung dịch sulfuric acid đặc, nóng với copper.
 Xem đáp án
Xem đáp án
Hiện tượng: Lá đồng tan dần, thoát ra khí không màu, mùi hắc, dung dịch thu được có màu xanh.
1) Phương trình hoá học:
Chất khử là: Cu; chất oxi hoá là: H2SO4.
2) Dung dịch sulfuric acid đặc, nóng có tính oxi hoá mạnh, có thể oxi hoá kim loại kém hoạt động như copper…
Câu 8:
Chuẩn bị: đường mía (C12H22O11), dung dịch sulfuric acid đặc; cốc thuỷ tinh loại 100
mL.
Tiến hành:
– Lấy khoảng 10 g đường mía cho vào cốc.
– Nhỏ đều trên bề mặt đường mía khoảng 2 mL dung dịch sulfuric acid đặc.
Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cẩn thận khi sử dụng.
Quan sát, mô tả hiện tượng xảy ra và thực hiện yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.
2. Dự đoán hiện tượng khi cho dung dịch sulfuric acid đặc tiếp xúc với các carbohydrate khác như cellulose (giấy, bông), tinh bột (gạo).
 Xem đáp án
Xem đáp án
Hiện tượng: Đường mía dần dần hoá than, có hiện tượng sủi bọt đẩy C trào ra ngoài cốc.
1) Phương trình hoá học của phản ứng xảy ra:
C12H22O11 12C + 11H2O
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O.
b) Dự đoán: Dung dịch sulfuric acid đặc có khả năng lấy nước từ các hợp chất carbohydrate như cellulose (giấy, bông), tinh bột (gạo) và khiến chúng hoá đen (hiện tượng than hoá).
Câu 9:
a) Viết phương trình hoá học của phản ứng khi cho lần lượt các chất rắn sodium chloride (NaCl), sodium bromide (NaBr) tác dụng với dung dịch sulfuric acid đặc.
b) Chỉ ra vai trò của sulfuric acid trong mỗi phản ứng đó.
 Xem đáp án
Xem đáp án
a) Phương trình hoá học của phản ứng:
NaCl + H2SO4 (đặc) NaHSO4 + HCl (1)
2NaBr + 3H2SO4 → 2NaHSO4 + Br2 + SO2 + 2H2O (2)
b) Phản ứng (1) không có sự thay đổi số oxi hoá của các nguyên tố, H2SO4 đặc đóng vai trò là acid.
Phản ứng (2) số oxi hoá của sulfur giảm từ +6 xuống +4, sulfuric acid đóng vai trò là chất oxi hoá.
Câu 10:
Sưu tầm tài liệu và trình bày về các ứng dụng của sulfuric acid trong các ngành sản xuất và đời sống. Vì sao sulfuric acid là hoá chất có tầm quan trọng bậc nhất?
 Xem đáp án
Xem đáp án
Mỗi năm cả thế giới cần đến hàng trăm triệu tấn sulfuric acid. Trong đó, gần 50% lượng acid được dùng để sản xuất phân bón như ammonium sulfate, calcium dihydrogenphosphate (Ca(H2PO4)2), … Acid này còn được sử dụng trong sản xuất chất tẩy rửa, sơn, phẩm màu, thuốc trừ sâu, giấy, chế hoá dầu mỏ,…
Sulfuric acid là một hoá chất công nghiệp rất quan trọng, sản lượng sulfuric acid của mỗi quốc gia là một chỉ số tốt về sức mạnh công nghiệp của quốc gia đó vì thế sulfuric acid là hoá chất có tầm quan trọng bậc nhất.
Câu 11:
Dung dịch sulfuric acid đặc được sử dụng để sản xuất phosphoric acid và phân bón superphosphate từ quặng phosphorite và apatite. Hãy viết phương trình hoá học của phản ứng giữa dung dịch sulfuric acid đặc với Ca3(PO4)2 trong hai quặng trên.
 Xem đáp án
Xem đáp án
Phương trình hoá học:
Ca3(PO4)2 + 2H2SO4 (đặc) → Ca(H2PO4)2 + 2CaSO4.
Ca3(PO4)2 + 3H2SO4 (đặc) → 2H3PO4 + 3CaSO4.
Câu 12:
Tìm hiểu thêm và trình bày về các ứng dụng của muối sulfate mà em biết.
 Xem đáp án
Xem đáp án
Các muối sulfate có nhiều ứng dụng trong đời sống:
+ Ammonium sulfate ((NH4)2SO4) ở dạng tinh thể màu trắng, chủ yếu được dùng làm phân bón, cung cấp đạm cho đất.
+ Magnesium sulfate (MgSO4) ở dạng tinh thể màu trắng, chủ yếu được sử dụng làm phân bón. Muối này còn được dùng làm thuốc để cung cấp magnesium cho cơ thể, giúp giảm các cơn đau cơ, giảm hiện tượng chuột rút…
+ Thạch cao nung (CaSO4. 0,5 H2O) khi nhào trộn với nước có khả năng đông cứng rất nhanh, nhờ tính chất này thạch cao nung được sử dụng làm vật liệu xây dựng, nặn đúc tượng và khuôn đúc, bó chỉnh hình trong y học. Ngoài ra, thạch cao nung còn được dùng làm chất phụ gia trong chế biến thực phẩm với hàm lượng cho phép nhất định. Chất này giúp đông tụ protein trong đậu phụ, phô mai; hạn chế hiện tượng nhão của bột làm bánh; giữ nước bên trong các loại mứt…
+ Barium sulfate (BaSO4) ở dạng tinh thể màu trắng, được sử dụng rộng rãi trong các lĩnh vực như sơn, mực in, nhựa, lớp phủ, men, thuỷ tinh, khai thác khoáng sản, sản xuất các loại giấy trắng chất lượng cao. Trong y tế, barium sulfate là thành phần chính của thuốc cản quang trong kĩ thuật X – quang.
Câu 13:
Chuẩn bị: dung dịch Na2SO4, dung dịch BaCl2; ống nghiệm, kẹp gỗ.
Tiến hành:
- Lấy khoảng 1 mL dung dịch Na2SO4 cho vào ống nghiệm.
- Nhỏ vài giọt dung dịch BaCl2 vào ống nghiệm, lắc nhẹ.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu:
1. Viết phương trình hoá học dạng phân tử và ion rút gọn.
2. Dự đoán hiện tượng khi nhỏ dung dịch BaCl2 vào ống nghiệm đựng dung dịch H2SO4 loãng.
 Xem đáp án
Xem đáp án
Hiện tượng: Xuất hiện kết tủa trắng.
1) Phương trình hoá học dạng phân tử:
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Phương trình hoá học dạng ion thu gọn:
2) Dự đoán hiện tượng khi nhỏ dung dịch BaCl2 vào ống nghiệm đựng dung dịch H2SO4 loãng là xuất hiện kết tủa trắng barium sulfate theo phương trình hoá học:
H2SO4 + BaCl2 → BaSO4 + 2HCl.
Câu 14:
Trình bày phương pháp hoá học để phân biệt các cặp dung dịch sau:
a) BaCl2 và NaCl;
b) H2SO4 loãng và HCl.
 Xem đáp án
Xem đáp án
a) Phân biệt cặp dung dịch BaCl2 và NaCl bằng dung dịch chứa ion sulfate như H2SO4; Na2SO4 …. Hiện tượng:
+ Xuất hiện kết tủa trắng → BaCl2. Phương trình ion thu gọn:
+ Không có hiện tượng xuất hiện → NaCl.
b) Phân biệt cặp dung dịch H2SO4 loãng và HCl bằng dung dịch chứa ion Ba2+ như BaCl2; Ba(NO3)2 …. Hiện tượng:
+ Xuất hiện kết tủa trắng → H2SO4. Phương trình ion thu gọn:
+ Không có hiện tượng xuất hiện → HCl.
Câu 15:
Bảo quản và sử dụng sulfuric acid an toàn, biết cách sơ cứu các trường hợp bỏng acid.
 Xem đáp án
Xem đáp án
- Cách bảo quản sulfuric acid:
+ Sulfuric acid được bảo quản trong chai, lọ có nút đậy chặt, đặt ở vị trí chắc chắn.
+ Đặt chai, lọ đựng dung dịch sulfuric acid đặc tránh xa các lọ chứa chất dễ gây cháy, nổ như chlorate, perchlorate, permanganate, dichromate.
- Cách sử dụng sulfuric acid để đảm bảo an toàn:
Sulfuric acid gây bỏng khi rơi vào da, do vậy cần tuân thủ các nguyên tắc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đổ nước vào dung dịch acid đặc.
- Cách sơ cứu khi bị bỏng acid:
Khi bị bỏng sulfuric acid cần thực hiện sơ cứu theo các bước sau:
(1) Nhanh chóng rửa ngay với nước lạnh nhiều lần để làm giảm lượng acid bám trên da. Nếu bị bỏng ở vùng mặt nhưng acid chưa bắn vào mắt thì nhắm chặt mắt khi ngâm rửa. Nếu acid đã bắn vào mắt thì úp mặt vào chậu nước sạch, mở mắt và chớp nhiều lần để rửa acid.
(2) Sau khi ngâm rửa bằng nước, cần tiến hành trung hoà acid bằng dung dịch NaHCO3 loãng (khoảng 2%).
(3) Băng bó tạm thời vết bỏng bằng băng sạch, cho người bị bỏng uống bù nước điện giải rồi đưa đến cơ sở y tế gần nhất.
