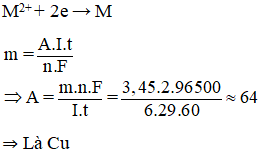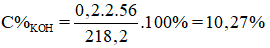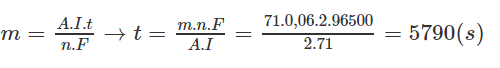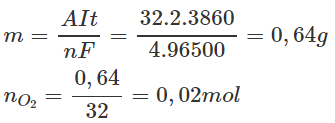SBT Hóa học 12 Bài 21: Điều chế kim loại
-
2191 lượt thi
-
24 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Khi điện phân có màng ngăn dung dịch muối ăn bão hoà trong nước thì xảy ra hiện tượng nào trong số các hiện tượng cho dưới đây ?
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 2:
Phương pháp điều chế kim loại bằng cách dùng đơn chất kim loại có tính khử mạnh hơn để khử ion kim loại khác trong dung dịch muối được gọi là
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 3:
Điện phân bằng điện cực trơ dung dịch muối sunfat của kim loại hoá trị II với dòng điện có cường độ 6A. Sau 29 phút điện phân thấy khối lượng catot tăng 3,45 g. Kim loại đó là
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 4:
Điện phân 200 ml dung dịch KOH 2M (D = 1,1 g/cm3) với điện cực trơ. Khi ở catot thoát ra 2,24 lít khí (đktc) thì ngừng điện phân. Biết rặng nước bay hơi không đáng kể. Dung dịch sau điện phân có nồng độ phần trăm là
 Xem đáp án
Xem đáp án
Đáp án A.
Khi điện phân:
(K): 2H2O + 2e → 2OH- + H2
nH2 = 0,1 mol ⇒ ne nhận = 0,2 mol
(A): 2H2O → 4H+ + O2 + 4e
Bảo toàn e ta có: ne cho = n e nhận = 0,2 mol
nO2 = ¼ n e cho = 0,05 mol
mdung dịch sau phản ứng = mdd ban đầu – mO2 – mH2 = 200.1,1 – 0,1.2 – 0,05.32 = 218,2g
Câu 5:
Trong số những công việc sau, công việc nào không được thực hiện trong công nghiệp bằng phương pháp điện phân ?
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 6:
Có thể thu được kim loại nào trong số các kim loại sau : Cu, Na, Ca, Al bằng cả 3 phương pháp điều chế kim loại phổ biến (nhiệt luyện, thuỷ luyện, điện phân) ?
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 7:
Dãy gồm các kim loại được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng là
 Xem đáp án
Xem đáp án
Đáp án A.
Câu 8:
Cho luồng khí H2 dư qua hỗn hợp các oxit sau : CuO, Fe2O3, ZnO, MgO nung ở nhiệt độ cao. Sau phản ứng hoàn toàn hỗn hợp rắn còn lại là
 Xem đáp án
Xem đáp án
Đáp án A.
Câu 9:
Từ mỗi chất Cu(OH)2, NaCl, FeS2, lựa chọn phương pháp thích hợp (các điều kiện khác có đủ) để điều chế ra các kim loại tương ứng. Khi đó, số phản ứng hoá học tối thiểu phải thực hiện để điều chế được 3 kim loại Cu, Na, Fe là
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 10:
Từ các chất riêng biột: CuSO4, CaCO3, FeS để điều chế được các kim loại Cu, Ca, Fe thì số phản ứng hoá học tối thiểu phải thực hiện là (các điều kiện khác có đủ)
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 12:
Trong các phương pháp sau, phương pháp nào điều chế được Cu có độ tinh khiết cao từ Cu(0H)2.CuC03 (X)?
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 13:
Trong phương pháp thủy luyện dùng để điều chế Ag từ quặng có chứa Ag2S, cần dùng
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 16:
Trong quá trình điện phân dung dịch NaCl bằng điện cực trơ có màng ngăn:
 Xem đáp án
Xem đáp án
Đáp án B
Câu 17:
Trong quá trình điện phân dung dịch CuS)4 với các điện cực bằng Cu, nhận thấy:
 Xem đáp án
Xem đáp án
Đáp án C
Câu 18:
Trong quá trình điện phân dung dịch CuSO4 với các điện cực bằng graphit, nhận thấy
 Xem đáp án
Xem đáp án
Đáp án B
Câu 19:
Hỗn hợp X gồm Fe, FeO và Fe2O3. Cho một luồng khí CO đi qua ống sứ đựng m g hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm thu được 64g chất rắn A trong ống sứ và 11,2 lít khí B (đktc) có tỉ khối so với H2 là 20,4. Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án C
Fe2O3 + CO → 2Fe3O4 + CO2
Fe3O4 + CO → 3FeO + CO2
FeO + CO → Fe + CO2
Ta thấy: nCO pư = nCO2
nB = 11,2 : 22,4 = 0,5 mol
Gọi x là số mol của CO2 ta có phương trình về khối lượng của B:
44x + 28(0,5 – x) = 0,5.20,4.2 = 20,4
⇒ x = 0,4 mol = nCO pư
Bảo toàn khối lượng ta có:
mX + mCO = mA + mCO2
⇒ mX = m = 64 + 0,4.44 – 0,4.28 = 70,4
Câu 20:
Từ những hợp chất riêng biệt : Cu(OH)2, MgO, FeS2, hãy nêu phương pháp thích hợp để điều chế Cu, Mg, Fe. Viết phương trình hoá học của các phản ứng.
 Xem đáp án
Xem đáp án
Cu(OH)2 → CuCl2 đpdd→ Cu
MgO → MgCl2 đpnc→ Mg
FeS2 &rarrl; Fe2O3 → Fe
4FeS2 + 11O2 to→ 2Fe2O3 + 8SO2
Fe2O3 + 3CO to→ 2Fe + 3CO2
Câu 21:
Bằng những phương pháp nào người ta có thể điều chế Cu từ dung dịch Cu(NO3)2, Ca từ dung dịch CaCl2? Viết phương trình hoá học của các phản ứng.
 Xem đáp án
Xem đáp án
- Điều chế Cu từ Cu(NO3)2 :
2Cu(NO3)2 + 2H2O đpdd→ 2Cu + O2 + 4HNO3
2Cu(NO3)2 to→ 2Cu + 4NO2 + O2
CuO + H2 to→ Cu + H2O
Điều chế Ca từ CaCl2 : cô cạn dung dịch CaCl2 rồi điện phân nóng chảy.
CaCl2 đpdd→ Ca + Cl2
Câu 22:
Trình bày phương pháp hoá học điều chế các kim loại Ca, Na, Cu từ những muối riêng biệt: CaCO3, Na2SO4, Cu2S.
 Xem đáp án
Xem đáp án
Có thể điểu chế kim loại theo các sơ đồ sau :
a) CaCO3 HCl→ CaCl2 đpnc→ Ca
b) Na2SO4 BaCl2→ NaCl đpnc→ Na
c) Cu2S O2→ CuO H2→ Cu
CuO HCl→ CuCl2 đpdd→ Cu
Câu 23:
Từ các chất riêng biệt : CuSO4, CaCO3, FeS cần điều chế được các kim loại Cu, Ca, Fe. Viết PTHH của các phản ứng xảy ra. (Các điều kiện khác có đủ).
 Xem đáp án
Xem đáp án
Điều chế Cu:
2CuSO4 + 2H2O đpdd→ 2Cu + O2 + 2H2SO4
Điều chế Ca: CaCO3 + 2HCl → CaCl2 + H2O + CO2CaCl2 đpnc→ Ca + Cl2
Điều chế Fe: FeS+ 2HCl → FeCl2 + H2S
Fe + Cl2 đpnc→ FeCl2
Câu 24:
Điện phân (điện cực trơ) dung dịch X chứa 0,2 mol CuSO4 và 0,12 mol NaCl bằng dòng điện có cường độ 2A. Tính thể tích khí (đktc) thoát ra ở anot sau 9650 giây điện phân.
 Xem đáp án
Xem đáp án
Trong quá trình điện phân cation nào có tính oxi hoá mạnh hơn sẽ thu e trước, anion nào có tính khử mạnh hơn sẽ nhường e trước. Trong dung dịch đã cho thứ tự như sau :
- Ở catot: Cu2+ > H+(H2O) > Na+
- Ở anot: Cl- > OH-(H2O) > SO42-
Ghép các ion thành phân tử để viết pt điện phân. Các ion Cl- và Cu2+ điện phân trước
CuCl2 đpdd→ Cu + Cl2 (1)
2CuSO4 + 2H2O đpdd→ 2Cu + O2 + 2H2SO4 (2)
Thời gian cần thiết để điện phân ở (1):
Thời gian còn lại để điện phân (2) là: 9650- 5790= 3860 (s)
Tính khối lượng O2 thu được khi điện phân trong 3860 s:
Tổng số mol khí thu được ở anot là: 0,06+0,02=0,08 mol
Thể tích khí thu được ở anot là: 0,08.22,4=1,792 (l)