SBT Hóa học 12 Bài 26: Kim loại kiềm thổ
-
1328 lượt thi
-
33 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Ở trạng thái cơ bản, nguyên tử kim loại kiém thổ có số electron hoá trị là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 2:
Chỉ dùng thêm thuốc thử nào cho dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch: H2SO4, BaCl2, Na2SO4?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 3:
Cho các chất : Ca, Ca(OH)2, CaCO3, CaO. Dựa vào mối quan hệ giữa các hợp chất vô cơ, dãy biến đổi nào sau đây có thể thực hiện được ?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 6:
Trong một dung dịch có a mol Ca2+, b mol Mg2+, c mol Cl , d mol HCO3 . Biểu thức liên hệ giữa a, b, c, d là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 7:
Trong nước tự nhiên thường có lẫn một lượng nhỏ các muối Ca(NO3)2, Mg(NO3)2, Ca(HCO3)2, Mg(HCO3)2. Có thể dùng dung dịch nào sau đây để loại đồng thời các cation trong các muối trên ra khỏi nước?
 Xem đáp án
Xem đáp án
Đáp án C
Câu 8:
Có thể loại bỏ tính cứng tạm thời của nước bằng cách đun sôi vì lí do nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 9:
Để oxi hoá hoàn toàn một kim loại M hoá trị II thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án C
Oxit là MO
Khối lượng oxi bằng 40% khối lượng của M nên . 100 = 40
⟹ M = 40 ⟹ Kim loại là Ca.
Câu 10:
Nung hỗn hợp muối cacbonat của hai kim loại kế tiếp nhau trong nhóm IIA tới khối lượng không đổi thu được 2,24 lít CO2 (đktc) và 4,64 g hỗn hợp hai oxit. Hai kim loại đó là
 Xem đáp án
Xem đáp án
Đáp án A
Gọi công thức chung của 2 kim loại là M
MCO3 → MO + CO2
0,1 0,1 0,1 (mol)
MMO = 4,64 : 0,1 = 46,4 ⇒ MM = 46,4 – 16 = 30,4
⇒ 2 kim loại là Mg (24); Ca (40)
Câu 11:
Để trung hoà dung dịch hỗn hợp X chứa 0,1 mol NaOH và 0,15 mol Ba(OH)2 cần bao nhiêu lít dung dịch hỗn hợp Y chứa HC1 0,1M và H2SO4 0,05M?
 Xem đáp án
Xem đáp án
Đáp án B
Dung dịch X có:
nOH- = 0,1 + 0,15.2 = 0,4 mol
nH+ cần = 0,4 mol
1 lít dung dịch Y có:
nH+ = 0,1 + 0,05.2 = 0,2 mol
V dd axit = 0,4/0,2 = 2l
Câu 12:
Cho hỗn hợp 2 muối cacbonat của kim loại hoá trị II trong dung dịch HCl dư thu được 6,72 lít khí (đktc). Cô cạn dung dịch sau phản ứng thấy khối lượng muối khan thu được nhiều hơn khối lượng hai muối cacbonat ban đầu là
 Xem đáp án
Xem đáp án
Đáp án D
nCO2 = nmuối cacbonat = 0,3 mol
Ta có: 1 mol muối cacbonat → 1 mol muối clorua khối lượng tăng thêm = 71 – 60 = 11g
⇒ 0,3 mol muối cacbonat → 0,3 mol clorua khối lượng tăng: 0,3.11 = 3,3g
Câu 13:
Cho a gam hỗn hợp BaCO3 và CaCO3 tác dụng hết với V lít dung dịch HCl 0,4M thấy giải phóng 4,48 lít C02 (đktc), dẫn khí thu được vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa thu được là
 Xem đáp án
Xem đáp án
Đáp án C
nCO2 = nCaCO3 sinh ra = 0,2 mol
⇒ m↓ = 0,2.100 = 20g
Câu 14:
Cho a gam hỗn hợp BaCO3 và CaCO3 tác dụng hết với V lít dung dịch HCl 0,4M thấy giải phóng 4,48 lít C02 (đktc), dẫn khí thu được vào dung dịch Ca(OH)2 dư. Thể tích dung dịch HCl cần dùng là
 Xem đáp án
Xem đáp án
2H+ + CO32- → CO2 + H2O
0,4 ← 0,2 0,2 (mol)
V = 0,4 : 0,4 = 1 lít
Câu 15:
Cho a gam hỗn hợp BaCO3 và CaCO3 tác dụng hết với V lít dung dịch HCl 0,4M thấy giải phóng 4,48 lít C02 (đktc), dẫn khí thu được vào dung dịch Ca(OH)2 dư. Giá trị của a nằm trong khoảng nào dưới đây ?
 Xem đáp án
Xem đáp án
Đáp án C
nmuối cacbonat = 0,2 mol
⇒ 0,2.100 < a < 0,2.197 ⇒ 20 < a < 39,4
Câu 16:
Trong một cốc nước có chứa 0,O3 mol Na+ 0,01 mol Ca2+ ; 0,01 mol Mg2+ ; 0,04 mol HCO3- 0,01 mol Cl ; 0,01 mol SO42-. Nước trong cốc thuộc loại
 Xem đáp án
Xem đáp án
Đáp án A
Câu 17:
Trong một cốc nước chứa 0,02 mol Ca2+ ; 0,01 mol Mg2+ ; 0,04 mol HCO3- ; 0,02 mol Cl- . Nước trong cốc thuộc loại
 Xem đáp án
Xem đáp án
Đáp án C
Câu 18:
Trong các phương pháp sau, phương pháp chỉ khử được tính cứng tạm thời của nước là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 19:
Vì sao tính chất vật lí của kim loại nhóm IIA không biến đổi theo một quy luật nhất định ?
 Xem đáp án
Xem đáp án
Sự biến đổi không theo quy luật do kim loại nhóm IIA có những kiểu mạng tinh thể khác nhau : mạng lục phương (Be, Mg) ; mạng lập phương tâm diện (Ca, Sr); mạng lập phương tâm khối (Ba).
Câu 20:
So sánh kim loại Mg và Ca về các mặt:
a) Cấu hình electron của nguyên tử.
b) Tác dụng với nước.
c) Phương pháp điều chế các đơn chất.
 Xem đáp án
Xem đáp án
a) Cấu hình electron : Mg : [Ne]3s2; Ca : [Ar]4s2
b) Tác dụng với nước : Ca tác dụng với nước ở điều kiện thường còn Mg không tác dụng.
c) Phương pháp điều chế : Cả Ca và Mg đều được điều chế bằng phương pháp điện phân nóng chảy hai muối MgCl2 và CaCl2.
Câu 21:
Hãy dẫn ra những phản ứng để chứng tỏ rằng từ Be đến Ca, tính kim loại của các nguyên tố tăng dần.
 Xem đáp án
Xem đáp án
Phản ứng vớỉ nước :
- Be không tác dụng với nước ở nhiệt độ thường.
- Mg tác dụng chậm với nước nóng.
- Ca tác dụng với nước ở nhiệt độ thường
Tính chất của hiđroxit :
Be(OH)2 có tính lưỡng tính.
Mg(OH)2 là bazơ yếu.
Ca(OH)2 là bazơ mạnh.
Câu 22:
Sục hỗn hợp khí CO2 và CO vào dung dịch Ca(OH)2 thấy có kết tủa. Lọc bỏ kết tủa, thu được dung dịch nước lọc. Đổ dung dịch NaOH vào nước lọc thấy xuất hiện kết tủa. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm trên.
 Xem đáp án
Xem đáp án
CO2 + Ca(OH)2 → CaCO3↓+ H2O (1)
CaCO3 + CO2 + H2O → Ca(HCO3)2 (2)
Ca(HCO3)2 + 2NaOH → CaCO3+ Na2CO3 + 2H2O (3).
Câu 23:
Nước trong vùng có núi đá vôi thuộc loại nước cứng. Viết phương trình hoá học của các phản ứng mô tả sự tạo thành nước cứng.
 Xem đáp án
Xem đáp án
Trong thành phần của đá vôi có các hợp chất CaCO3, MgCO3. Nước mưa hoà tan khí CO2 trong không khí đã hoà tan dần các hợp chất CaCO3,MgCO3
CaCO3 + CO2 + H2O → Ca(HCO3)2
MgCO3 + CO2 + H2O &rarrl Mg(HCO3)2
Câu 24:
Về mặt hoá học thì nước có tính cứng tạm thời và nước có tính cứng vĩnh cửu khác nhau ở điểm nào ?
 Xem đáp án
Xem đáp án
Khác nhau về thành phần anion của muối.
- Nước có tính cứng tạm thời chứa anion HCO3- khi đun nóng bị phân huỷ thành ion cacbonat làm kết tủa Ca2+ và Mg2+ .
- Nước có tính cứng vĩnh cửu chứa các anion SO42- và Cl-, khi đun nóng không làm kết tủa Ca2+ và Mg2+
Câu 25:
Có 4 cốc đựng riêng biệt các loại nước : nước cất, nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần. Hãy xác định loại nước đựng trong 4 cốc trên bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng đã dùng.
 Xem đáp án
Xem đáp án
Đun sôi nước trong các cốc ta sẽ chia ra thành 2 nhóm :
(1) Không thấy vẩn đục là nước cất và nước có tính cứng vĩnh cửu.
(2) Thấy vẩn đục là nước có tính cứng tạm thời và nước có tính cứng toàn phần.
+ Thêm vài giọt dung dịch Na2CO3 vào mỗi cốc của nhóm (1). Nếu có kết tủa là nước có tính cứng vĩnh cửu, không có kết tủa là nước cất.
+ Lấy nước lọc của mỗi cốc ở nhóm (2) (sau khi đun sôi để nguội) cho thêm vài giọt dung dịch Na2CO3. Nếu có kết tủa là nước có tính cứng toàn phần, không có kết tủa là nước có tính cứng tạm thời.
Câu 26:
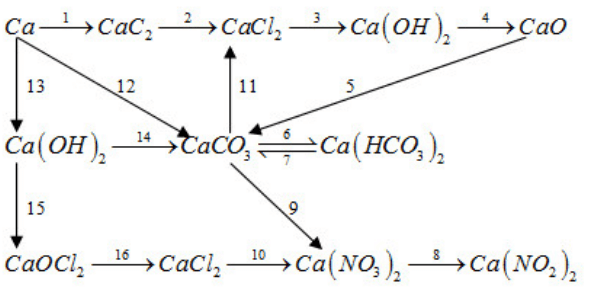
Viết PTHH của các phản ứng trong sơ đồ biến hoá sau:
 Xem đáp án
Xem đáp án
(1) Ca + 2C → CaC2
(2) CaC2 + 2HCl→ CaCl2 + C2H2
(3) CaCl2 + 2H2O đpdd→ Ca(OH)2 + Cl2 + H2
(4) Ca(OH)2 to→ CaO + H2O
(5) CaO + CO2 → CaCO3
(6) CaCO3 + CO2 + H2O → Ca(HCO3)2
(7) Ca(HCO3)2 to→ CaCO3 + CO2 + H2O
(8) Ca(NO3)2 → Ca(NO2)2 + O2
(9) CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
(10) CaCl2 + 2AgNO3 → Ca(NO3)2 + AgCl
(11) CaCO3 + 2HCl → CaCl2 + H2O + CO2
(12) Ca + CO2 + H2O → CaCO3 + H2
(13) Ca + 2H2O → Ca(OH)2 + H2
(14) Ca(OH)2 dư + CO2 → CaCO3 + H2O
(15) Ca(OH)2 + Cl2 → CaOCl2 + H2O
(16) CaOCl2 + 2HCl → CaCl2 + H2O + CO2
Câu 27:
Viết phương trình phản ứng trong sơ đồ biến hóa sau:
MgCl2 Mg MgO Mg(NO3)2 MgO MgCl2 Mg(OH)2 MgO MgSO4 MgCO3 Mg(HCO3)2
 Xem đáp án
Xem đáp án
(1) MgCl2 đpnc→ Mg + Cl2
(2) 2Mg + O2 → 2MgO
(3) MgO + 2HNO3 → Mg(NO3)2 + H2O
(4) 2Mg(NO3)2 to→ 2MgO + 4NO2 + O2
(5) MgO + 2HCl → MgCl2 + H2O
(6) MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
(7) Mg(OH)2 to→ MgO + H2O
(8) MgO + H2SO4 → MgSO4 + H2O
(9) MgSO4 + Na2CO3 → MgCO3 + Na2SO4
(10) MgCO3 + CO2 + H2O → Mg(HCO3)2
Câu 28:
Hỗn hợp X chứa K2O, NH4Cl, NaHCO3 và BaCl2 có số mol mỗi chất đều bằng nhau. Cho hỗn hợp X vào nước dư, đun nóng thu được dung dịch Y. Xác định các ion có trong dung dịch Y.
 Xem đáp án
Xem đáp án
Giả sử ban đầu mỗi chất đều là a mol.
Khi cho vào nước thì chỉ có K2O tác dụng với nước
K2O + H2O → 2KOH
a → 2a (mol)
KOH + NH4Cl → KCl + NH3 + H2O
a a (mol)
2KOH + 2NaHCO3 → K2CO3 + Na2CO3 + 2H2O
a a 0,5a 0,5a (mol)
CO3 2- + Ba 2+ → BaCO3
(0,5a + 0,5a) a
Vậy cuối cùng chỉ còn K +, Na+ và Cl-
Câu 29:
Cho 8 g hỗn hợp gồm một kim loại kiềm thổ và oxit của nó tác dụng vừa đủ với 1 lít dung địch HC1 0,5M. Xác định kim loại kiềm thổ.
 Xem đáp án
Xem đáp án
Gọi kim loại kiềm thổ là X (có khối lượng mol là M), oxit của nó là XO.
X + 2HCl → XCl2 + H2 (1)
XO + 2HCl → XCl2 + H2O (2)
Gọi x, y là số mol của kim loại kiềm thổ và oxit của nó. Số mol HCl tham gia phản ứng (1) và (2) là 0,5 mol.
Ta có hệ pt: Mx+ (M+16y) = 8
2x+2y = 0,5
Giải hệ phương trình ta được : x = M-16/64
Biết 0 < x < 0,25, ta có : 0 < M-16/64 < 0,25
→ 0 < M - 16 < 16 => 16 < M < 32 Vậy kim loại kiềm thổ có nguyên tử khối bằng 24, đó là Mg.
Câu 30:
Khi lấy 11,1 g muối clorua của một kim loại chỉ có hoá trị II và một lượng muối sunfat của kim loại đó có cùng số mol, thấy khác nhau 2,5 g. Xác định công thức hoá học của hai muối.
 Xem đáp án
Xem đáp án
Đặt công thức của các muối là MCl2 và MSO4.
Gọi x là số mol mỗi muối. Theo đề bài ta có .
(M + 96)x - (M + 71)x = 2,5 → x = 0,1 (mol)
Khối lượng mol của MCl2 là 11,1/0,1 = 111g/mol
Nguyên tử khối của M là 111- 71 = 40 => M là Ca . Công thức các muối là CaCl2 và CaSO4.
Câu 31:
Sục V lít khí CO2 (đktc) vào bình đựng 2 lít dung dịch Ca(OH)2 0,0IM, thu được 1 g kết tủa. Xác định V
 Xem đáp án
Xem đáp án
Sục khí CO2 vào dung dịch Ca(OH)2 thu được 1 g kết tủa thì có 2 trường hợp xảy ra.
Trường hợp 1 : Phản ứng chỉ tạo ra 1 g kết tủa :
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
Theo đề bài : nCa(OH)2 = 0,01.2 = 0,02 (mol). Vậy Ca(OH)2 dư.
VCO2 = 22,4.0,01 = 0,224 (lít).
Trường hợp 2 : Phản ứng tạo ra nhiều hơn 1 g kết tủa, sau đó tan bớt trong CO2 dư còn lại 1 g.
CO2 + Ca(OH)2 → CaCO3 + H2O
0,02 0,02 0,02 (mol)
CaCO3 + CO2 + H2O → Ca(HCO3)2
0,01 0,01 (mol)
VCO2 = 22,4.(0,02 + 0,01) = 0,672 (lít).
Câu 32:
Chỉ dùng nước và dung dịch HCl hãy trình bày cách nhận biết 4 chất rắn (đựng trong 4 lọ riêng biệt) : Na2CO3, CaCO3, Na2SO4, CaSO4.2H2O
 Xem đáp án
Xem đáp án
Hoà vào nước ta được hai nhóm chất :
(1) Tan trong nước là Na2CO3 và Na2SO4. Phân biệt 2 chất này bằng dung dịch HCl. Tác dụng với dung dịch HCl là Na2CO3 (sủi bọt khí) ; không tác dụng với dung dịch HCl là Na2SO4.
(2) Không tan trong nước là CaCO3 và CaSO4.2H2O. Dùng dung dịch HCl để nhận ra CaCO3 (có sủi bọt khí) còn lại là CaSO4.2H2O.
Câu 33:
Hoà tan 23,9 g hỗn hợp bột BaCO3 và MgCO3 trong nước cần 3,36 lít CO2 (đktc). Xác định khối lượng của mỗi muối trong hỗn hợp
 Xem đáp án
Xem đáp án
BaCO3 + CO2 + H2O → Ba(HCO3)2 (1)
MgCO3 + CO2 +H2O → Mg(HCO3)2 (2)
Số mol CO2 đã cho là : 0,15 (mol)
Đặt x và y là số mol của BaCO3 và MgCO3 ta có hệ phương trình :
x + y = 0,15
197x + 84y = 23,9
→x = 0,1 và y = 0,05
mBaCO3 = 197.0,1 = 19,7 (g)
mMgCO3 = 23,9 - 19,7 = 4,2 (g).