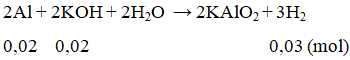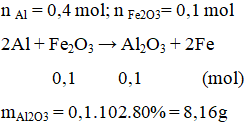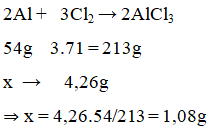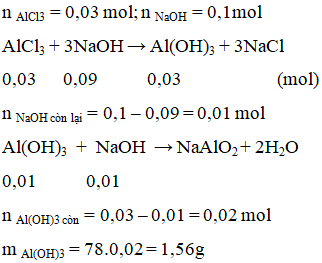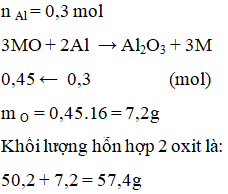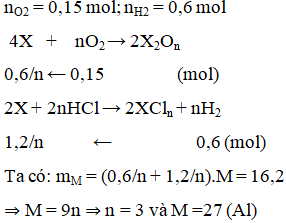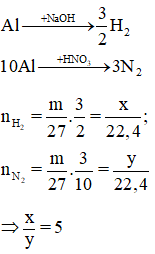SBT Hóa học 12 Bài 27: Nhôm và hợp chất của nhôm
-
1330 lượt thi
-
24 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 2:
Chỉ dùng hoá chất nào sau đây có thể phân biệt 3 chất rắn là Mg, Al và Al2O3 ?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 3:
Các dung dịch ZnSO4 và AlCl3 đéu không màu. Để phân biệt 2 dung dịch này có thế dùng dung dịch của chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 4:
Hiện tượng nào sau đây đúng khi cho từ từ dung dịch NH3 đến dư vào ống nghiệm đựng dung dịch AlCl3 ?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 5:
Trong 1 lít dung dịch Al2(SO4)3 0,15M có tổng số mol các ion do mue phân li ra (bỏ qua sự thuỷ phân của muối) là
 Xem đáp án
Xem đáp án
Đáp án D
Al2(SO4)3 → 2Al3+ + 3SO42-
Số mol ion = 2 nAl3+ + 3nSO42- = 5n Al2(SO4)3 = 5.0,15 = 0,75 mol
Câu 6:
Hòa tan m gam Al tác dụng hết với dung dịch HNO3 rất loãng chỉ thu được hỗn hợp khí gồm 0,015 mol N2O và 0,01 mol NO. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
ne nhận = 8nN2O + 3nNO = 8.0,015 + 3.0,01 = 0,15 = ne cho = 3nAl
⇒ nAl = 0,03 mol ⇒ mAl = 0,81g
Câu 7:
Cho 5,4 g Al vào 100 ml dung dịch KOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn thể tích khí H2 (đktc) thu được là
 Xem đáp án
Xem đáp án
Đáp án C
nKOH = 0,1.0,2 = 0,02 mol; nAl = 0,2 mol
Al dư; VH2 = 0,03.22,4 = 0,672 lít
Câu 8:
Nung nóng hỗn hợp gồm 10,8 g bột Al với 16 g bột Fe2O3 (không có không khí), nếu hiệu suất phản ứng là 80% thì khối lượng Al2O3 thu được là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 9:
Đốt cháy bột Al trong bình khí Cl2 dư, sau khi phản ứng xảy ra hoàn toàn khối lượng chất rắn trong bình tăng 4,26 g. Khối lượng Al đã phản ứng là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 10:
Cho 4,005 g AlCl3 vào 1000 ml dung dịch NaOH 0,1M. Sau khi phản ứng xong thu được khối lượng kết tủa là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 11:
Để khử hoàn toàn m gam hỗn hợp CuO và PbO cần 8,1 g kim loại nhôm sau phản ứng thu được 50,2 g hỗn hợp 2 kim loại. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 12:
Cho 16,2 g kim loại X (có hoá trị n duy nhất) tác dụng với 3,36 lít O2 (đktc), phản ứng xong thu được chất rắn A. Cho A tác dụng hết với đung dịch HCl thấy có 1,2 g khí H2 thoát ra. Kim loại X là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 13:
Khi cho m gam Al tác dụng với dung dịch NaOH dư được X lít khí và khi cho cũng m gam Al tác dụng với HNO3 loãng dư được y lít khí N2 duy nhất (các thể tích khí đo ở cùng điều kiện). Quan hệ giữa x và y là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 16:
Tại sao Al khử H2O rất chậm và khó, nhưng lại khử H2O dễ dàng trong dung dịch kiềm mạnh, giải phóng khí H2 ? Kiềm giữ vai trò gì trong phản ứng này ? Viết phương trình hoá học của các phản ứng.
 Xem đáp án
Xem đáp án
Al khử H2O rất khó khăn, không thu được khí H2 vì Al phản ứng với nước tạo ra màng bảo vệ là Al(OH)3, nó ngăn không cho Al tiếp xúc với nước. Trong dung dịch kiềm mạnh (NaOH, KOH,...) màng bảo vệ Al(OH)3 sinh ra liền bị phá huỷ, do đó Al khử H2O dễ dàng, giải phóng khí H2.
2Al + 6H2O → 2Al(OH)3+ 3H2 (1)
Al(OH)3 + NaOH → NaAlO2 +2H2O (2)
Hai phản ứng trên xảy ra luân phiên nhau, cho tới khi Al bị oxi hoá hết. Ở đây, kiềm giữ vai trò hoà tan màng bảo vệ Al(OH)3, tạo điều kiện cho Al khử H2O dễ dàng.
Câu 17:
Có gì giống nhau và khác nhau khi nhỏ từ từ cho đến dư :
a) Dung dịch NH3 vào dung dịch AlCl3 ?
b) Dung dịch Ba(OH)2 vào dung dịch AlCl3 ?
 Xem đáp án
Xem đáp án
a) Kết tủa tạo ra không tan trong dung dịch NH3 dư :
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
b) Kết tủa tạo ra tan trong dung dịch Ba(OH)2 dư :
2AlCl3 + 3Ba(OH)2 → 2Al(OH)3 + 3BaCl2
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O.
Câu 18:
Tuỳ thuộc vào nồng độ của dung dịch HNO3, Al có thể khử HNO3 thành NO2, N2O, NO, N2, NH4NO3. Viết phương trình hoá học của các phản ứng
 Xem đáp án
Xem đáp án
Các phương trình hoá học :
Al + 6HNO3→ Al(NO3)3 + 3NO2 + 3H2O
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
10Al + 36HNO3 → 10Al(NO3)3 + 3N2 + 18H2O
8Al + 30HNO3 →8Al(NO3)3 + 3NH4NO3 + 9H2O.
Câu 19:
Có 4 kim loại riêng biệt là Na, Ca, Cu, Al. Hãy nhận biết mỗi kim loại bằng phương pháp hoá học và viết các phương trình hoá học.
 Xem đáp án
Xem đáp án
Dùng H2O để phân thành 2 nhóm kim loại : Nhóm (1) gồm Na và Ca, nhóm (2) gồm Cu và Al. Sản phẩm là các dung dịch NaOH và Ca(OH)2.
Dùng CO2 nhận biết dung dịch Ca(OH)2, suy ra chất ban đầu là Ca. Kim loại còn lại ở nhóm (1) là Na.
Kim loại nào ở nhóm (2) tác dụng với dung dịch NaOH tạo bọt khí, kim loại đó là Al. Kim loại còn lại ở nhóm (2) là Cu.
Câu 20:
Chỉ dùng những chất ban đầu là NaCl, H2O, Al hãy điều chế :
a) AlCl3.
b) Al(OH)3.
c) Dung dịch NaAlO2
 Xem đáp án
Xem đáp án
a) Hoà tan NaCl vào nước tới bão hoà rồi điện phân dung dịch :
2NaCl + 2H2O đpdd→ H2 + Cl2 + 2NaOH (1)
Thu Cl2 cho phản ứng với Al :
2Al + 3Cl2→2AlCl3 (2)
- Lấy AlCl3 vừa điều chế được (2) cho tác dụng với NaOH ở (1) :
AlCl3 + 3NaOH (vừa đủ) →Al(OH)3 + 3NaCl (3)
- Lấy Al(OH)3 điều chế được ở (3) cho tác dụng với NaOH :
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Câu 21:
Có gì giống và khác nhau khi cho khí CO2 và dung dịch HCl loãng tác dụng với dung dịch NaAlO2? Viết phương trình hoá học của các phản ứng xảy ra.
 Xem đáp án
Xem đáp án
- Kết tủa xuất hiện, không tan trong CO2 dư :
NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3
- Kết tủa xuất hiện rồi tan trong dung dịch HCl dư :
NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
Al(OH)3 + 3HCl → AlCl3 + 3H2O.
Câu 22:
Cho 13,5 g Al vào dung dịch NaOH nóng, lấy dư.
a) Viết phương trình hoá học của phản ứng dưới dạng phân tử và ion thu gọn.
b) Tính thể tích khí H2 bay ra ở 735 mmHg và 22,5°C.
 Xem đáp án
Xem đáp án
a) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
natri aluminat
2Al + 2OH- + 2H2O → 2AlO2- + 3H2
ion aluminat
b) nAl = 13,5/27 = 0,5 mol
nH2 = 3/2 nAl = 3/2 . 0,5 = 0,75 mol
VH2 = nRt/P = 18,8l
Câu 23:
Hoà tan 0,12 mol FeCl3, 0,15 mol MgSO4 và 0,16 mol A12(SO4)3 vào dung dịch chứa 0,4 moi H2SO4 và 0,1 mol HCl được dung dịch X. Cho 254 ml dung dịch NaOH 10M vào X được m gam kết tủa. Xác định giá trị của m.
 Xem đáp án
Xem đáp án
n Fe3+ = 0,12 mol n Mg2+ = 0,15 mol n Al3+ = 0,32 mol
n H+ = 0,9 mol n OH- = 2,54 mol
Khi cho NaOH vào dd X thì:
(1) H+ + OH- → H2O
→ n OH- = n H+ = 0,9mol
(2) Fe3+ + 3OH- → Fe(OH)3↓
→ n OH- = 3n Fe3+ = 3.0,12= 0,36 mol
(3) Mg2+ + 2OH- → Mg(OH)2 ↓
→ n OH- = 2 n Mg2+ = 2.0,15=0,3mol
Từ (1),(2) và (3) → n OH- (dư) = 2,54- 0,9- 0,36- 0,3= 0,98 mol
(4) Al3+ + 3OH- → Al(OH)3↓
→ n OH- = 3n Al3+ = 3.0,32=0,96 mol
Do OH- dư 0,02 mol nên tiếp tục có pứ:
(5) Al(OH)3 + OH- → AlO2- + 2H2O
→ n Al(OH)3 = 0,32 -0,02 = 0,3 mol
Vậy kết tủa gồm Fe(OH)3: 0,12 mol, Mg(OH)2: 0,15 mol, Al(OH)3: 0,3 mol
→ m ↓= 0,12.107+ 0,15.58+ 0,3.78 = 44,94g
Câu 24:
Cho 100 ml dung dịch NaOH X mol/1 (x > 0,4M) vào dung dịch chứa 0,02 mol MgCl2 và 0,02 mol AlCl3. Lọc lấy kết tủa và nung đến khối lượng không đổi được m gam chất rắn. Để m nhỏ nhất thì giá trị của X bằng bao nhiêu.
 Xem đáp án
Xem đáp án
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
Al(OH)3 + 3NaOH → Al(OH)3↓ + 3NaCl
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Kết tủa nhỏ nhất khi Al(OH)3 tan hết
→ nNaOH = 2n MgCl2 + 3n AlCl3 + n Al(OH)3
= 2.0,02 + 3.0,02 + 0,02 = 0,12 mol
Vậy x = 0,12/0,1 = 1,2M