100 câu trắc nghiệm Nito - Photpho cơ bản (P3)
-
3171 lượt thi
-
20 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Dẫn khí X đi qua ống sứ đựng CuO nung nóng, thu được hỗn hợp khí và hơi Y. Cho Y lần lượt qua ống (1) đựng CuSO4 khan dư và ống 2 đựng nước vôi trong. Thấy ống 1 chất rắn chuyển từ màu trắng sang màu xanh và ống 2 thấy nước vôi trong không bị vẩn đục. Vậy khí X là:
 Xem đáp án
Xem đáp án
Đáp án C
2NH3+ 3CuO →toN2+ 3Cu + 3H2O (1)
X là NH3, Y chứa N2, H2O, có thể NH3 dư
- Cho Y qua ống (1) đựng CuSO4 khan:
CuSO4 khan+ 5H2O → CuSO4.5H2O
Trắng xanh
- Cho Y qua ống 2 đựng nước vôi trong: không có phản ứng nên nước vôi không bị vẩn đục
Đáp án A không đúng vì nếu X là CH4 thì Y chứa CO2, H2O
Khi cho Y qua nước vôi trong thì nước vôi trong bị vẩn đục do :
CO2+ Ca(OH)2 → CaCO3+ H2O
Đáp án B không đúng vì khí H2S không tác dụng với CuO
Đáp án D không đúng vì khí HCl không tác dụng với CuO
Câu 2:
Tính lượng quặng photphoric chứa 90% canxi photphat dùng để điều chế 6,2 kg photpho nếu hiệu suất các phản ứng đều là 80%?
 Xem đáp án
Xem đáp án
Đáp án A
Ta có sơ đồ phản ứng:
Ca3(PO4)2 → 2P
Theo sơ đồ : nCa3(PO4)2= ½. nP= ½. 6200/31=100 mol
→mCa3(PO4)2= 100. 310= 310 00 gam= 31 kg
Do hiệu suất đạt 80% nên mCa3(PO4)2 thực tế= 31.100/80=38,75 gam
→ mquặng= 38,75.100/90=43,056 kg
Câu 3:
Cho khí NH3 dư đi từ từ vào dung dịch X (chứa hỗn hợp CuCl2, FeCl3, AlCl3) thu được kết tủa Y. Nung kết tủa Y ta được chất rắn Z, rồi cho luồng khí NH3 dư đi từ từ qua Z nung nóng thu được chất rắn R. Trong R chứa:
 Xem đáp án
Xem đáp án
Đáp án D
3NH3+ AlCl3+ 3H2O→ 2Al(OH)3+3 NH4Cl (1)
3NH3+ FeCl3+ 3H2O→ 2Fe(OH)3+3 NH4Cl (2)
2NH3+ CuCl2+ 2H2O→ Cu(OH)2+2 NH4Cl (3)
4NH3+ Cu(OH)2 → [Cu(NH3)4](OH)2 (4)
Do NH3 dư nên sau phản ứng chỉ thu được kết tủa Y gồm Al(OH)3 và Fe(OH)3
2Al(OH)3→toAl2O3+ 3H2O (5)
2Fe(OH)3→toFe2O3+ 3H2O (6)
Chất rắn Z chứa Al2O3, Fe2O3
NH3 là chất khử chỉ khử được các oxit kim loại sau nhôm trong dãy hoạt động hóa học
2NH3+ Fe2O3→toN2+ 2Fe + 3H2O (1)
Vậy chất rắn R chứa Al2O3 và Fe
Câu 4:
Cho 1,42 gam P2O5 tác dụng hoàn toàn với 50 ml dung dịch KOH 1M, thu được dung dịch X. Cô cạn dung dịch X thu được chất rắn khan gồm:
 Xem đáp án
Xem đáp án
Đáp án D
Ta có P2O5+ 3H2O→2H3PO4
nH3PO4= 2.nP2O5=0,02 mol, nKOH=0,05 mol
Ta xét tỉ lệ T= nKOH/ nH3PO4= 0,05/0,02= 2,5
→ 2 < T < 3
→ Khi H3PO4 tác dụng với KOH xảy ra 2 phương trình sau:
H3PO4+ 2KOH→ K2HPO4+2 H2O
H3PO4+ 3KOH→ K3PO4+3 H2O
Cô cạn dung dịch X thu được K2HPO4 và K3PO4
Câu 5:
Dẫn 1,344 lít khí NH3 vào bình chứa 0,672 lít khí Cl2 (đktc). Thành phần % thể tích của mỗi khí trong hỗn hợp khí sau phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án A
Ta có nNH3= 0,06 mol; nCl2= 0,03 mol
2NH3+ 3Cl2 →N2+ 6HCl (1)
Ban đầu 0,06 0,03
Phản ứng 0,02 0,03 0,06 mol
Sau pứ 0,04 0,06 mol
Sau phản ứng thu được 0,04 mol NH3 và 0,06 mol HCl
→%VNH3= 40%; %VHCl= 60%
Câu 6:
Cho dung dịch NH3 đến dư vào 20 ml dung dịch Al2(SO4)3. Để hòa tan hết kết tủa thu được sau phản ứng cần tối thiểu 10 ml dung dịch NaOH 2M. Nồng độ mol của dung dịch Al2(SO4)3 ban đầu là:
 Xem đáp án
Xem đáp án
Đáp án B
6NH3+ Al2(SO4)3+ 6H2O→ 2Al(OH)3+3 (NH4)2SO4 (1)
NaOH + Al(OH)3 → NaAlO2+ H2O (2)
Có nAl(OH)3= nNaOH= 0,01.2= 0,02 mol
→ nAl2(SO4)3= 12. nAl(OH)3= 0,01 mol
→ CM Al2(SO4)3= 0,01/ 0,02= 0,5M
Câu 7:
Cho phản ứng tổng hợp ammoniac:
N2+ 3H2 ⇌ 2 NH3
Khi giảm nồng độ NH3 (các yếu tố khác giữ nguyên) thì phản ứng sẽ chuyển dịch theo chiều nào?
 Xem đáp án
Xem đáp án
Đáp án A
Theo nguyên lí chuyển dịch cân bằng khi giảm nồng độ NH3 thì cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó tức là chuyển dịch theo chiều thuận.
Câu 8:
Trong 3 oxit: FeO, Fe2O3, Fe3O4 thì chất nào phản ứng với HNO3 đặc nóng không tạo ra khí là:
 Xem đáp án
Xem đáp án
Đáp án A
Fe2O3+ 6 HNO3→ 2Fe(NO3)3+ 3H2O
FeO + 4HNO3 đặc nóng → Fe(NO3)3+ NO2↑+2 H2O
3Fe3O4 + 28HNO3 đặc nóng → 9Fe(NO3)3+ NO2↑+ 14H2O
Câu 9:
Cho V lít (đktc) hỗn hợp N2 và H2 có tỉ lệ mol 1:4 vào bình kín và đun nóng. Sau phản ứng thu được 1,5 mol NH3. Biết hiệu suất phản ứng là H= 25%. Giá trị của V là:
 Xem đáp án
Xem đáp án
Đáp án C
Do 11>43 →Hiệu suất tính theo N2
Đặt số mol N2 ban đầu là x mol
→ nH2 ban đầu= 4x mol;
Do hiệu suất phản ứng là 25% nên
nN2 pứ= 25%.x= 0,25x mol
Ban đầu x 4x
Phản ứng 0.25x 0.75x 0.5x mol
Sau pứ 0.75x 3.25x 0.5x mol
Sau phản ứng nNH3= 0,5x= 1,5 suy ra x=3 mol
→V= 22,4. (x+4x)= 22,4.5.3=336 lít
Câu 10:
Từ 10 m3 hỗn hợp N2 và H2 lấy theo tỉ lệ 1:3 về thể tích, biết hiệu suất phản ứng tổng hợp thực tế là 95%. Có thể sản xuất được lượng amoniac là:
 Xem đáp án
Xem đáp án
Đáp án C
Ở cùng điều kiện tỉ lệ về số mol bằng tỉ lệ thể tích
Đặt VN2=x m3, VH2= 3x m3
→ Vhh= x+ 3x= 10 m3 → x= 2,5
→ VN2=2,5 m3, VH2= 7,5 m3
Ta có VN2 / 1= VH2 / 3 nên hiệu suất tính theo N2 hoặc H2
VN2 pứ= VN2.95%= 2,375 m3
N2+ 3H2 ⇌ 2NH3
2,375 → 4,75 m3
Câu 11:
Phải dùng bao nhiêu lít khí nitơ để điều chế 17 gam NH3 biết hiệu suất phản ứng là 25%, các thể tích đo ở đktc.
 Xem đáp án
Xem đáp án
Đáp án A
N2+ 3H22NH3
nNH3= 1mol
Theo PTHH: nN2 (PT)= ½.nNH3= 0,5 mol;
Vì H=25% nên
(thực tế) = 0,5 : 25% = 2 mol
=2.22,4=44.8 lít
Câu 12:
Cho phản ứng: N2+ 3 H2 ⇌ 2 NH3
Sau một thời gian, nồng độ các chất như sau: [N2]= 2,5 mol/l; [H2]= 1,5 mol/l; [NH3]= 2 mol/l. Nồng độ ban đầu của N2 và H2 lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án D
Nồng độ ban đầu của N2 và H2 lần lượt là: x, y mol/l
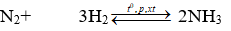
Ban đầu x y mol/l
Phản ứng 1 3 2mol/l
Sau pứ x-1 y-3 2mol/l
Ta có: [N2]= 2,5 mol/l= x-1 nên x= 3,5M
[H2]= 1,5 mol/l= y-3 nên y=4,5M
Câu 13:
Hiệu suất của phản ứng giữa N2 và H2 tạo thành sẽ tăng nếu:
 Xem đáp án
Xem đáp án
Đáp án D
N2 + 3H2 2NH3, ∆H <0
Khi tăng áp suất cân bằng chuyển dịch theo chiều làm giảm số mol khí (tức là chiều thuận)
Phản ứng thuận có ∆H <0 là phản ứng tỏa nhiệt
Nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thuận (tỏa nhiệt)
Vậy hiệu suất của phản ứng giữa N2 và H2 tạo thành sẽ tăng nếu: tăng áp suất và giảm nhiệt độ.
Câu 14:
Tính số mol P2O5 cần thêm vào 0,3 lít dung dịch hỗn hợp KOH 1M và NaOH 1M để sau phản ứng thu được dung dịch chứa hai anion HPO42- và H2PO4- với số mol bằng nhau:
 Xem đáp án
Xem đáp án
Đáp án B
P2O5+ 3H2O → 2 H3PO4 (1)
Tổng số mol OH- có trong dung dịch là 0,3.1+0,3.1= 0,6 mol
Đặt số mol HPO42- là x mol, số mol H2PO4- là x mol
OH-+ H3PO4 →H2PO4-+ H2O (2)
2OH-+ H3PO4 → HPO42-+ 2H2O (3)
Theo PT (2), (3) có:
nOH-= nH2PO4-+ 2nHPO4(2-)= x+ 2x= 3x (mol)= 0,6
Suy ra x= 0,2 mol→ nH3PO4 PT (2), (3)= x+ x= 0,4 mol
→nP2O5= ½. nH3PO4= 0,2 mol
Câu 15:
Để làm khô khí amoniac có thể dùng hóa chất nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án C
Để làm khô khí amoniac có thể dùng CaO khan vì CaO khan có khả năng hút ẩm nhưng không phản ứng với amoniac:
CaO + H2O → Ca(OH)2
Không lựa chọn H2SO4 đặc vì:
2NH3+ H2SO4→ (NH4)2SO4
Không lựa chọn P2O5 vì:
P2O5+ 3H2O → 2 H3PO4
Sau đó H3PO4 phản ứng với NH3 theo PT:
3NH3+ H3PO4→ (NH4)3PO4
Không lựa chọn CuSO4 khan vì:
2NH3+ CuSO4+ 2H2O→ Cu(OH)2+(NH4)2SO4
4NH3+ Cu(OH)2 → [Cu(NH3)4](OH)2
Chất được chọn để làm khô phải có khả năng hút nước và không phản ứng với chất cần làm khô
Câu 16:
Để điều chế 4 lít NH3 từ N2 và H2 với hiệu suất 50% thì thể tích H2 cần dùng ở điều kiện là bao nhiêu?
 Xem đáp án
Xem đáp án
Đáp án D
N2 + 3H22NH3
Theo PT VH2=3/2VNH3= 6 lít
Do hiệu suất 50% nên:
VH2 thực tế= 100. VH2/50= 100.6/50= 12 lít
Câu 17:
Thể tích hỗn hợp N2 và H2 (đktc) cần lấy để điều chế 102 gam NH3 (H=25%) là:
 Xem đáp án
Xem đáp án
Đáp án C
N2+ 3H2 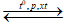 2NH3
2NH3
Ta có nNH3=6mol
Theo PT: nN2= ½. nNH3= 3 mol,
nH2= 3/2nNH3=9 mol
Do hiệu suất bằng 25% nên:
nN2 thực tế= nN2.100/25=12 mol
Ta có nH2 thực tế= nH2.100/25= 9.4= 36 mol
→Tổng nhỗn hợp= 12+ 36= 48 mol
→ Vhỗn hợp= 48.22,4=1075,2 lít
Câu 18:
Để điều chế 2 lít khí NH3 từ N2 và H2 với hiệu suất 25% thì cần bao nhiêu lít khí N2 ở cùng điều kiện?
 Xem đáp án
Xem đáp án
Đáp án C.
N2 + 3H2 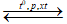 2NH3
2NH3
Trong cùng điều kiện thì tỉ lệ thể tích bằng tỉ lệ số mol
Theo PT : VN2= ½. VNH3= 1 lít, VH2= 3/2. VNH3=3 lít
Do hiệu suất 25% nên VN2 thực tế= VN2.100/25= 4 lít
Câu 19:
Đưa một hỗn hợp khí N2 và H2 có tỉ lệ 1:3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Tính thành phần phần trăm về thể tích của hỗn hợp khí sau phản ứng:
 Xem đáp án
Xem đáp án
Đáp án B
Chọn thể tích ban đầu của N2 là 1 lít, H2 là 3 lít
→ Thể tích ban đầu là 4 lít
→Thể tích khí giảm là Vkhí giảm= 1/10.Vban đầu= 1/10.4= 0,4 lít
→VNH3 sinh ra= Vban đầu- Vsau= Vkhí giảm= 0,4 lít
N2+ 3H22NH3
VN2 pứ= 1/2VNH3 sỉnh = 0,2 lít,
VH2 pứ= 3/2.VNH3sinh= 0,6 lít
→VN2 dư= 0,8 lít, VH2 dư= 3-0,6= 2,4 lít
Tổng thể tích khí sau phản ứng là:
Vsau=9/10.Vban đầu= 0,9.4= 3,6 lít
→%VN2 dư= 0,8.100%/3,6=22,22%;
%VH2 dư= 2,4.100%/3,6=66,67%
%VNH3=11,11%
Câu 20:
Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Hiện tượng xảy ra là:
 Xem đáp án
Xem đáp án
Đáp án C
(NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
