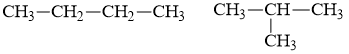Đề kiểm tra Hóa 11 học kì 1 có đáp án (đề 7)
-
3268 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Dung dịch KOH 0,001M cần pha loãng bằng nước bao nhiều lầm để được dung dịch có pH = 9?
 Xem đáp án
Xem đáp án
Đáp án C
Giả sử dung dịch ban đầu có thể tích là V lít → nKOH = 0,001.V (lít)
Dung dịch sau phản ứng có thể tích là V’ lít → [OH-] =
→
→
→ Cần pha loãng với nước 100 lần.
Câu 2:
Biết độ điện li của dung dịch axit CH3COOH 1,2M là 1,5%. Nồng độ mol/l của ion trong dung dịch trên là:
 Xem đáp án
Xem đáp án
Đáp án A
Gọi nồng độ mol/l của ion trong dung dịch trên là x.
Câu 3:
Sau khi trộn 100ml dung dịch HCl 1M với 400ml dung dịch NaOH 0,375M thì pH dung dịch sau khi pha trộn là:
 Xem đáp án
Xem đáp án
Đáp án C
⟹ Sau khi trộn dung dịch có môi trường bazơ.
Sau phản ứng [OH-] là
⟹ pH = 14 + lg(0,1)= 13
Câu 4:
Cho 1,92 gam Cu tác dụng vừa hết với V lít dung dịch HNO3 0,1M loãng giải phóng khí NO. Giá trị của V là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương trình hóa học:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Theo phương trình ta có:
⟹ V = lít
Câu 5:
Ngâm một vật bằng đồng có khối lượng 10 gam vào 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Khối lượng của vật sau phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án C
Khối lượng AgNO3 tham gia phản ứng là:
Số mol AgNO3 phản ứng là:
Phương trình hóa học:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
(Ag sinh ra bám vào vật)
⟹
Khối lượng của vật là: m = 10 – 0,005.64 + 0,01.108 = 10,76 gam
Câu 6:
Cho 19,2 gam đồng tác dụng hết với dung dịch HNO3 thu được hỗn hợp khí gồm NO và NO2, có tỉ khối hơi đối với H2 là 21. Thể tích hỗn hợp khí thu được (ở đktc) là:
 Xem đáp án
Xem đáp án
Đáp án B
Gọi số mol của khí NO và NO2 lần lượt là a và 3a (mol).
Bảo toàn electron ta có:
⟹ 2.0,3 = 3.a + 1.3a
⟹ a = 0,1
Thể tích hỗn hợp khí là: V = 22,4.(0,1 + 0,1.3) = 8,96 lít
Câu 7:
Cho 0,15 mol hỗn hợp NaHCO3 và MgCO3 tác dụng hết với dung dịch HCl. Khí thoát ra được dẫn vào dung dịch Ca(OH)2 dư thu được kết tủa có khối lượng là:
 Xem đáp án
Xem đáp án
Đáp án B
Ta có:
⟹
⟹
Câu 8:
Khử 32 gam Fe2O3 bằng khí CO dư ở nhiệt độ cao. Dẫn sản phẩm sinh ra vào bình Ca(OH)2 dư, thu được a gam kết tủa. Giá trị của a là:
 Xem đáp án
Xem đáp án
Đáp án D
Phương trình hóa học:
Fe2O3 + 3CO 2Fe + 3CO2
Ca(OH)2 + CO2 → CaCO3↓ + H2O
⟹
⟹
⟹ a = 0,6.100 = 60 gam
Câu 9:
Dãy gồm các ion cùng tồn tại trong một dung dịch là
 Xem đáp án
Xem đáp án
Đáp án A
Dãy các ion cùng tồn tại được trong dung dịch là K+, Ba2+, , .
Các đáp án B, C, D không thể cùng tồn tại trong 1 dung dịch vì có ion phản ứng với nhau.
Câu 10:
Phản ứng hóa học, trong đó cacbon có tính khử là
 Xem đáp án
Xem đáp án
Đáp án C
Cacbon thể hiện tính khử khi tác dụng với oxi.
Câu 11:
Cho các hợp chất: C2H6; C2H2; C2H4O2; C2H6O; C6H12O6. Hợp chất nào sau đây có hàm lượng cacbon cao nhất?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 12:
Đốt cháy hoàn toàn một hiđrocacbon (X) thu được . Vậy X là:
 Xem đáp án
Xem đáp án
Đáp án C
Ta có: ⟹ C : H = 1 : 4
⟹ Công thức đơn giản nhất là CH4
⟹ Công thức phân tử là (CH4)n.
⟹ n =1, công thức là CH4.
Câu 13:
Kim cương và than chì là các dạng:
 Xem đáp án
Xem đáp án
Đáp án D
Kim cương và than chì là các dạng thù hình của cacon.Câu 14:
Khí nitơ có thể được tạo thành trong phản ứng hóa học nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Phương trình hóa học:
4NH3 + 5O2 4NO + 6H2O
NH4NO2 N2 + 2H2O
2AgNO3 2Ag + 2NO2 + O2
NH4NO3 N2O + 2H2O
Câu 15:
Dung dịch A chứa 0,23 gam ion ; 0,12 gam ion ; 0,355 gam ion và m gam ion . Số gam muối khan sẽ thu được khi cô cạn dung dịch A là
 Xem đáp án
Xem đáp án
Đáp án A
Bảo toàn điện tích ta có:
⟹ m = 0,005.96 = 0,48 gam
Khối lượng khối khan là:
mmuối = 0,23 + 0,12 + 0,355 + 0,48 = 1,185 gam
Câu 16:
Chất nào sau đây có tên gọi là amoni hiđrosunfat?
 Xem đáp án
Xem đáp án
Đáp án A
Amoni hiđrosunfat có công thức là NH4HSO4.
Câu 17:
Trong công nghiệp, nitơ điều chế bằng cách:
 Xem đáp án
Xem đáp án
Đáp án C
Trong công nghiệp, nitơ điều chế bằng cách hóa lỏng không khí và chưng cất phân đoạn.
Câu 18:
Cho dung dịch NH3 dư vào dung dịch nhôm sunfat thì
 Xem đáp án
Xem đáp án
Đáp án C
Cho dung dịch NH3 dư vào dung dịch nhôm sunfat thì xuất hiện kết tủa không tan trong dung dịch NH3 dư.
Phương trình hóa học:
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3↓ + 3(NH4)2SO4Câu 19:
Cho 0,05 mol Mg tan hết trong dung dịch HNO3 thấy thoát ra 0,01 mol khí X là sản phẩm khử duy nhất (đktc). X là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi x là số electron mà N+5 nhận để chuyển thành khí X.
Áp dụng định luật bảo toàn electron ta có:
0,05.2 = 0,01.x ⟹ x = 10
⟹ Khí X là khí N2.
Câu 20:
N2 thể hiện tính khử trong phản ứng với
 Xem đáp án
Xem đáp án
Đáp án D
N2 thể hiện tính khử khi tác dụng với oxiCâu 21:
Nhiệt phân hoàn toàn 18,9 gam muối nitrat của một kim loại hóa trị II, thu được 5,6 lít hỗn hợp khí ở đktc. Kim loại đó là
 Xem đáp án
Xem đáp án
Đáp án D
Phương trình hóa học:
2M(NO3)2 2MO + 4NO2 + O2
⟹ Nhận thấy: ⟹
Theo phương trình: nmuối =
⟹
⟹ Kim loại này là Zn.
Câu 22:
Trong phản ứng Cu + HNO3 → Cu(NO3)2 + NO + H2O.
Tổng các hệ số (các số nguyên, tối giản) cân bằng trong phương trình của phản ứng oxi hóa - khử này là
 Xem đáp án
Xem đáp án
Đáp án A
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Câu 23:
Sản phẩm của phản ứng nhiệt phân Cu(NO3)2 là:
 Xem đáp án
Xem đáp án
Đáp án C
2Cu(NO3)2 2CuO + 4NO2 + O2
Câu 24:
Dãy chất nào sau đây, trong nước đều là chất điện li mạnh?
 Xem đáp án
Xem đáp án
Đáp án B
Dãy chất đều là chất điện li mạnh là: MgCl2 và Ba(OH)2.
Câu 26:
Cặp chất nào sau đây là đồng đẳng của nhau?
 Xem đáp án
Xem đáp án
Đáp án C
Đồng đẳng là những chất có hơn kém nhau 1 hay nhiều nhóm CH2 và có cấu tạo và tính chất hóa học tương tự nhau.
⟹ CH3OH và C2H5OH là đồng đẳng của nhau.
Câu 28:
Thể tích của 1,5 gam chất X bằng thể tích của 0,8 gam khí oxi (đktc cùng điều kiện nhiệt độ, áp suất). Phân tử khối của X là
 Xem đáp án
Xem đáp án
Đáp án A
Theo bài ta có:
Câu 29:
 Xem đáp án
Xem đáp án
Đáp án D
Ta có: MX = 44.2 = 88 đvC ⟹
Khối lượng oxi trong X là: = 4,4 – 0,2.12 – 2.0,2.1 = 1,6g
⟹
Số nguyên tử C trong X là:
Số nguyên tử H trong X là:
Số nguyên tử O trong X là:
⟹ Công thức của phân tử X là C4H8O2.
Câu 30:
Kết quả phân tích nguyên tố hợp chất X cho biết %mc = 54,54%; %mH = 9,09% còn lại là oxi. Tỉ khối hơi của X so với CO2 bằng 2. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Đáp án D
Ta có: MX = 44.2 = 88 đvC
= = 2 : 4 : 1
⟹ Công thức đơn giản nhất của X là C2H4O
⟹ Công thức phân tử có dạng (C2H4O)n.
⟹ 44n = 88 ⟹ n = 2
⟹ Công thức phân tử của X là C4H8O2.