Đề kiểm tra Hóa 11 học kì 1 có đáp án (đề 8)
-
3229 lượt thi
-
22 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chất khí nào sau đây được tạo ra từ bình chữa cháy và dùng để sản xuất đá khô?
 Xem đáp án
Xem đáp án
Đáp án C
Khí CO2 được tạo ra từ bình chữa cháy và dùng để sản xuất đá khô.
Câu 2:
Cho m gam Al phản ứng hoàn toàn với dung dịch HNO3 loãng (dư), thu được 4,48 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Phương trình hóa học:
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Ta có:
Áp dụng định luật bảo toàn electron:
⟹ m = 0,2.27 = 5,4 gam
Câu 3:
Khí amoniac làm giấy quỳ tím ẩm
 Xem đáp án
Xem đáp án
Đáp án A
Khí amoniac làm giấy quỳ tím ẩm chuyển thành màu xanh vì:
NH3 + H2O
⟹ Môi trường bazơ.
Câu 4:
Phương trình ion: là của phản ứng xảy ra giữa cặp chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Phản ứng xảy giữa cặp chất NaHCO3 và NaOH có phương trình ion là:
Câu 5:
Các nguyên tử thuộc nhóm IVA có cấu hình electron lớp ngoài cùng là:
 Xem đáp án
Xem đáp án
Đáp án D
Các nguyên tử thuộc nhóm IVA có cấu hình electron lớp ngoài cùng là ns2np2.
Câu 6:
Kim loại bị thụ động trong HNO3 đặc, nguội là
 Xem đáp án
Xem đáp án
Đáp án B
Al, Fe bị thụ động trong HNO3 đặc, nguội.
Câu 9:
Trong những nhận xét dưới đây về muối amoni, nhận xét nào là đúng?
 Xem đáp án
Xem đáp án
Đáp án B
Tất cả các muối amoni đều dễ tan trong nước, khi tan điện li hòa toàn thành cation amoni và anion gốc axit.
Câu 10:
Cho P tác dụng với Mg, sản phẩm thu được là
 Xem đáp án
Xem đáp án
Đáp án B
Phương trình hóa học:
3Mg + 2P Mg3P2
Câu 11:
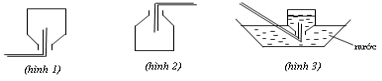
Kết luận nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án D
Hình 1 được áp dụng để thu khí nhẹ hơn không khí.
Hình 2 được áp dụng để thu khí nặng hơn không khí.
Hình 3 được áp dụng để thu khí không tan hoặc ít tan trong nước.Câu 12:
Khi nhiệt phân, dãy muối rắn nào dưới đây đều sinh ra kim loại, khí nitơ đioxit và oxi?
 Xem đáp án
Xem đáp án
Đáp án A
Khi nhiệt phân các muối AgNO3 hay Hg(NO3)2 đều sinh ra kim loại, khí NO2 và khí O2.
Câu 13:
Độ dinh dưỡng của phân lân được tính bằng
 Xem đáp án
Xem đáp án
Đáp án A
Độ dinh dưỡng của phân lân được tính bằng % về khối lượng của P2O5 trong phân.Câu 14:
Chất nào sau đây thuộc loại chất điện li yếu?
 Xem đáp án
Xem đáp án
Đáp án C
Chất điện li yếu là CH3COOH.
Phương trình điện li: CH3COOH ⇄
Câu 15:
Cho dung dịch KOH đến dư vào 50 ml (NH4)2SO4 1M. Đun nóng nhẹ, thu được thể tích khí thoát ra (đktc) là
 Xem đáp án
Xem đáp án
Đáp án D
Phương trình hóa học:
2KOH + (NH4)2SO4 →2NH3 + K2SO4 + 2H2O
⟹
⟹ lít
Câu 16:
Sục 0,15 mol khí CO2 vào 200 ml dung dịch Ba(OH)2 1M, kết thúc phản ứng thu được các chất:
 Xem đáp án
Xem đáp án
Đáp án D
Ta có:
Nhận thấy: ⟹ Sau phản ứng thu được chứa Ba(OH)2 dư và chất rắn BaCO3.
Câu 17:
Số liên kết xích-ma (Ϭ) trong phân tử C4H10 là:
 Xem đáp án
Xem đáp án
Đáp án B
Liên kết xích-ma là liên kết đơn. Liên kết đơn gồm C – C và C – H.
Số liên kết C – C là 4 – 1 = 3 liên kết.
Số liên kết C – H là 10 liên kết.
⟹ Tổng có 13 liên kết xích – ma.
Câu 18:
Cặp chất nào dưới đây là dồng phân của nhau?
 Xem đáp án
Xem đáp án
Đáp án A
Các chất là đồng phân của nhau khi có cùng công thức phân tử và khác nhau về công thức cấu tạo.
Các chất ở đáp án có cùng công thức phân tử là C3H8O.
Câu 19:
Chất nào sau đây là dẫn xuất của hiđrocacbon?
 Xem đáp án
Xem đáp án
Đáp án D
Dẫn xuất hidrocacbon là hợp chất hữu cơ ngoài chứa nguyên tố C và H còn chứa các nguyên tố khác như O, N, S, halogen, ...
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án B
Câu 21:
Cho 2,8 gam N2 tác dụng H2 lấy dư. Biết hiệu suất phản ứng đạt 20%. Tính thể tích của NH3 thu được sau phản ứng (đktc)?
 Xem đáp án
Xem đáp án
Phương trình hóa học:
N2 + 3H2 2NH3
⟹ Theo phương trình:
Do hiệu suất phản ứng đạt 20% nên lượng NH3 sinh ra thực tế là:
Thể tích khí NH3 thu được là: V = 0,04.22,4 = 0,896 lít
Câu 22:
Chia 19,4 gam hỗn hợp gồm Mg, Al, Zn thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một trong O2 dư thu được 15,7 gam hỗn hợp oxit. Phần hai hòa tan trong dung dịch HNO3 đặc, nóng dư thu được V (lít) NO2 (sản phẩm khử duy nhất, (đktc)). Tính giá trị của V.
 Xem đáp án
Xem đáp án
Ta có: m1 = m2 = gam
- Phần 1: Phản ứng với oxi
Số mol oxi phản ứng là:
Các quá trình nhường, nhận electron
Al → + 3e
Mg → + 2e
Zn → + 2e.
Bảo toàn electron ta có:
ne nhường = ne nhận ⟹ ne nhường = 0,1875.4 = 0,75 (1)
- Phần 2: hoàn tan trong dung dịch HNO3
Các quá trình nhường, nhận electron
Al → + 3e
Mg → + 2e
Zn → + 2e.
Gọi số mol khí NO2 là a mol.
Ta có: ne nhường = ne nhận ⟹ ne nhường = a (2)
Từ (1) và (2) ⟹ 0,75 = a
⟹ lít
