Đề thi Hóa học 11 giữa kì 1 có đáp án (Đề 7)
-
3922 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Theo thuyết A-rê-ni-ut:Axit là chất khi tan trong nước phân li ra cation H+.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hidroxit lưỡng tính là hidroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Al(OH)3\[ \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \] Al3++ 3OH-
Al(OH)3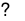 AlO2-+ H++ H2O
AlO2-+ H++ H2O
Câu 3:
Chất nào sau đây là muối axit?
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Muối axit là muối mà anion gốc axit vẫn còn hiđro có khả năng phân li ra ion H+.
Vậy NaH2PO4 là muối axit.
Câu 4:
Chọn phát biểu đúng trong số các phát biểu sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
pH = -lg[H+] ⇒ [H+] giảm thì pH tăng, độ axit giảm.
Câu 5:
Chất nào sau đây tác dụng với Ba(OH)2tạo kết tủa?
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Ca(HCO3)2+ Ba(OH)2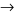 BaCO3↓ + CaCO3↓ +2H2O
BaCO3↓ + CaCO3↓ +2H2O
Câu 6:
Chất nào sau đây tác dụng với HCl dư tạo ra chất khí?
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Na2CO3+ 2HCl → 2NaCl + H2O + CO2↑
Câu 7:
Dung dịch nào sau đây không dẫn được điện?
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Các dung dịch NaCl, NaOH, HCl đều dẫn điện.
Câu 8:
Phương pháp dùng để điều chế N2 trong phòng thí nghiệm?
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
NH4NO2 N2+ 2H2O
N2+ 2H2O
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
NaOH là chất điện li. Phương trình điện li:
NaOH → Na++ OH-
Câu 10:
Một oxit nitơ có CTPT dạng NxOytrong đó nitơ chiếm 30,43% về khối lượng. Oxit đó có công thức là
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Nitơ chiếm 30,43% về khối lượng:
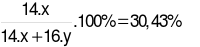
Lập giá trị x = 1; y
= 2 thỏa mãn.
Oxit là NO2.
Câu 11:
Đối với dung dịch axit mạnh HNO30,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
HNO3→ H++ NO3-
⇒[H+] = [NO3-] = 0,10M
Câu 12:
Dãy các chất đều tác dụng được với dung dịch Ba(HCO3)2là
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Ba(HCO3)2+ 2HNO3→ Ba(NO3)2+ 2H2O + 2CO2↑
Ba(HCO3)2+ Ca(OH)2\( \to \) BaCO3↓ + CaCO3↓ +2H2O
Ba(HCO3)2+Na2SO4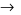 BaSO4↓+ 2NaHCO3
BaSO4↓+ 2NaHCO3
Câu 13:
Cho dung dịch Ba(HCO3)2lần lượt vào các dung dịch sau: HNO3, Na2SO4, Ba(OH)2, NaHSO4. Số trường hợp có phản ứng xảy ra là
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Ba(HCO3)2+ 2HNO3→ Ba(NO3)2+ 2H2O + 2CO2↑
Ba(HCO3)2+Na2SO4→ BaSO4↓+ 2NaHCO3
Ba(HCO3)2+ Ba(OH)2→ 2BaCO3↓ +2H2O
Ba(HCO3)2+ 2NaHSO4→ BaSO4↓+ Na2SO4+ 2H2O + 2CO2↑
Câu 14:
Dung dịch của một bazơ ở 25oC có
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Dung dịch bazơ: [H+] < 1,0.10-7M.
Câu 15:
Cho 2 lít N2và 7 lít H2vào bình phản ứng, hỗn hợp thu được sau phản ứng có thể tích bằng 8,2 lít (thể tích các khí đo ở cùng điều kiện). Hiệu suất phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C

Bài ra: 2 7 (lít)
Ở cùng điều kiện thì tỉ lệ về thể tích bằng tỉ lệ về số mol
Xét tỉ lệ:  ⇒ Hiệu suất tính theo N2
⇒ Hiệu suất tính theo N2
Đặt thể tích N2phản ứng là x lít
\({N_2} + 3{H_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \,2N{H_3}\)
Phản ứng: x3x 2x
Dư:2-x7-3x
Sau phản ứng thu được N2dư, H2dư, NH3.
Tổng thể tích khí thu được là
Vkhí = 7 - 3x + 2 – x + 2x = 8,2 lít
⇒ x = 0,4 lít
⇒ H% = 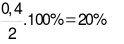
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là:C

Câu 17:
Một mẫu nước có pH = 3,82 thì nồng độ mol /l của ion H+trong đó là
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
[H+] = 1,0.10-pH
⇒ [H+] = 1,0.10-3,82 = 1,51.10-4M.
Câu 18:
Cặp chất nào sau đây tồn tại trong cùng một dung dịch?
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
NaCl, Al(NO3)3không phản ứng với nhau do không thỏa mãn điều kiện phản ứng trao đổi (tạo chất kết tủa, chất bay hơi hoặc chất điện li yếu) nên cùng tồn tại trong cùng một dung dịch.
Câu 19:
Cho các phát biểu về nitơ và hợp chất của nitơ
(1) Trong thiên nhiên, khí NOđược tạo thành khi có sấm sét.
(2) N2lỏng dùng để bảo quản mẫu máu và các mẫu sinh học khác.
(3) N2O là chất khí không màu, mùi dễ chịu, gây cười.
(4) NH3lỏng dùng làm chất làm lạnh trong thiết bị lạnh.
(5) Muối NH4HCO3được sử dụng làm xốp bánh.
Số phát biểu đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Tất cả các phát biểu đều đúng.
Câu 20:
Chất nào sau đây là chất điện li mạnh?
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion.
⇒ NaCl là chất điện li mạnh.
Câu 21:
Đối với dung dịch axit HNO20,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
HNO2 là chất điện li yếu.
HNO2 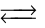 H++ NO2-
H++ NO2-
⇒[H+] < 0,10M.
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Amoniac là một bazơ khi tác dụng với axit
2NH3+ H2SO4→ (NH4)2SO4.
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
H2S là axit yếu, là chất điện li yếu.
Câu 24:
Người ta tiến hành thí nghiệm cho từ từ dung dịch chứa 2 gam Ca(NO3)2vào một dung dịch chứa 2 gam Na2CO3. Sau khoảng 5 phút tiếp tục nhỏ từ từ dung dịch HCl loãng dư vào, hiện tượng quan sát được là
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
Ca(NO3)2+ Na2CO3→ CaCO3↓+ 2NaNO3
 ⇒
⇒  dư
dư
Na2CO3+ 2HCl → 2NaCl + H2O + CO2↑
Câu 25:
Một phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành.
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp lại với nhau tạo thành ít nhất một trong các chất sau: chất kết tủa, chất bay hơi và chất điện li yếu.
Câu 26:
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Áp dụng bảo toàn điện tích ta có:
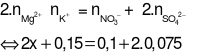
⇒ x= 0,05 (mol)
Câu 27:
Cặp ion cùng tồn tại trong một dung dịch là?
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
NH4+, NO3không phản ứng với nhau.
Câu 28:
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
[OH-] = 0,1M ⇒ [H+] =  = 10-13M
= 10-13M
⇒pH = -lg[H+]= -lg[10-13]=13.
Câu 29:
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
HCl→ H++ OH-
⇒ [H+] = 0,1 M
[ OH-] =  = 10-13M.
= 10-13M.
Câu 30:
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch các chất điện li.
Câu 31:
Một dung dịch có pH = 9. Cho biết màu của phenolphtalein trong dung dịch này.
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
pH = 9 ⇒ Môi trường bazơ.
Màu của phenolphtalein chuyển sang màu hồng.
Câu 32:
Trộn 200 ml dd HCl 0,005 M với 100 ml NaOH 0,01 M và KOH 0,03 M được 300 ml dung dịch. Giá trị pH của dung dịch tạo thành sau khi trộn là?
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
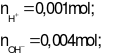
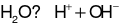
Vậy OH-dư 0,003 mol
[OH]-sau trộn=  M
M
Vậy pH của dung dịch sau trộn: pH = 14 + log[OH-] = 12.
Câu 33:
Khi nhúng mẩu giấy quỳ tím vào dung dịch nước chanh có giá trị pH khoảng 2,4 thì quỳ chuyển màu . . ., nếu nhúng mẩu giấy quỳ vào dung dịch amoniac có giá trị pH = 9,8 thì quỳ chuyển màu . . .
 Xem đáp án
Xem đáp án
Hướng dẫn giải: Chọn B
Khi nhúng mẩu giấy quỳ tím vào dung dịch nước chanh có giá trị pH khoảng 2,4 thì quỳ chuyển màu đỏ, nếu nhúng mẩu giấy quỳ vào dung dịch amoniac có giá trị pH = 9,8 thì quỳ chuyển màu xanh
Câu 34:
Cho các phản ứng sau
(1) HCl + NaOH →
(2) Ba(OH)2+ H2SO4 →
(3) CaO + HCl →
(4) HNO3+ Ca(OH)2 →
Trong các phản ứng trên có . . .phản ứng có cùng phương trình ion rút gọn.
 Xem đáp án
Xem đáp án
Hướng dẫn giải: Chọn A
Trong các phản ứng trên có 2 phản ứng có cùng phương trình ion rút gọn là (1) và (4).
Phương trình ion rút gọn: H++ OH-→ H2O
Câu 35:
Cho phản ứng hóa học FeS + 2X FeCl2+ H2S. Chất X trong phản ứng là .
 Xem đáp án
Xem đáp án
Hướng dẫn giải Chọn A
FeS + 2HCl FeCl2+ H2S
X là HCl
Câu 36:
Nếu em là axit
Anh sẽ là bazơ
Hai ta trung hòa lại
Được pH bằng bảy
Vậy khi trộn 400 ml dung dịch em axit có nồng độ H+ là 0,1 M với V ml dung dịch anh bazơ có nồng độ OH-là 0,4 thì giá trị của V là.
 Xem đáp án
Xem đáp án
Hướng dẫn giải chọn B

Câu 37:
Cho dung dịch NaOH dư vào 150 ml dung dịch (NH4)2SO41M, đun nóng nhẹ. Sau phản ứng hoàn toàn thu được V lít khí thoát ra ở đktc.
 Xem đáp án
Xem đáp án
Hướng dẫn giải chọn C
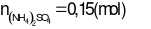
2NaOH + (NH4)2SO4→ Na2SO4+ 2NH3↑ + 2H2O
NaOH dư ⇒  = 0,3 (mol)
= 0,3 (mol)
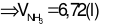 .
.
Câu 38:
Dung dịch A chứa các ion: Fe2+(0,05 mol), Al3+(0,1 mol), Cl- (. . .mol), SO42-(. . .mol). Cô cạn dung dịch A thu được 23,45 g muối khan.
 Xem đáp án
Xem đáp án
Hướng dẫn giải chọn A
Gọi số molCl-và SO42-lần lượt là x và y
Áp dụng định luật bảo toàn khối lượng ta có:
56.0,05 + 0,1.27 + x. 35,5 + y. 96 = 23,45
⇒ 35,5.x + 96.y = 17,95 (1)
Áp dụng bảo toàn điện tích ta có:
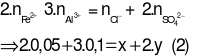
Từ (1) và (2) giải hệ phương trình được:
x= 0,1; y = 0,15
Câu 39:
Cho từ từ 200 ml dung dịch hỗn hợp HCl 1M và H2SO40,5M vào 300 ml dd Na2CO31M thu được . . .lít khí (ở đktc).
 Xem đáp án
Xem đáp án
Hướng dẫn giải chọn C
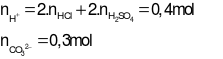
Cho từ từ H+vào CO32-nên thứ tự phản ứng như sau:
H++ CO32-→ HCO3-
0,3 ← 0,3 → 0,3mol
H++ HCO3-→ H2O + CO2
0,1 → 0,1 → 0,1mol
V = 0,1.22,4 = 2,24 lít
Câu 40:
Cho hỗn hợp X gồm 0,05 mol CaCl2; 0,03 mol KHCO3; 0,05 mol NaHCO3; 0,04 mol K2O; 0,03 mol Ba(NO3)2vào 437,57 gam H2O, sau khi phản ứng xảy ra hoàn toàn thu được . . .gam kết tủa và . . .gam dung dịch Y.
 Xem đáp án
Xem đáp án
Hướng dẫn giải chọn D
K2O + H2O → 2KOH
0,04 → 0,08mol
OH-+ HCO3-→ CO32-+ H2O
0,08 0,08 0,08mol
Ba2++ CO32-→ BaCO3↓
0,03 0,03 0,03
Ca2++ CO32-→ CaCO3↓
0,05 0,05 0,05
⇒ mkết tủa = 0,03.197 + 0,05.100 = 10,91g
⇒ 
= (0,05.111+ 0,03.100 + 0,05.84 + 0,04.94 + 0,03.261) + 437,57- 10,91= 451 gam
