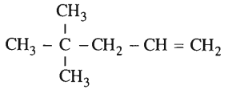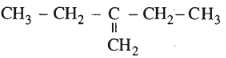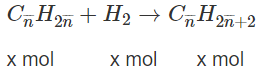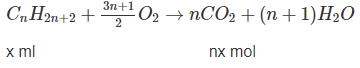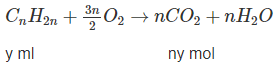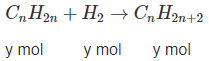Bài 29: Anken -SBT Hóa học 11
-
1493 lượt thi
-
14 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 4:
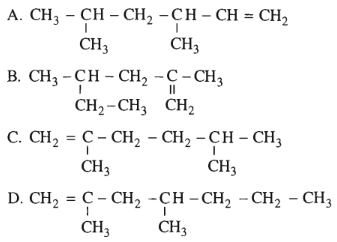
Hợp chất 2,4-đimetylhex-1-en ứng với công thức cấu tạo nào cho dưới đây?
 Xem đáp án
Xem đáp án
Đáp án: B.
Câu 5:
Để phân biệt etan và eten, dùng phản ứng nào cho dưới đây là thuận tiện nhất ?
 Xem đáp án
Xem đáp án
Đáp án: C.
Câu 6:
Chất X có công thức phân tử C4H8. X có thể làm mất màu dung dịch brom và khi tác dụng với HCl tạo ra một sản phẩm duy nhất. Tên chất X đó là
 Xem đáp án
Xem đáp án
Đáp án: C.
Câu 7:
Trình bày phương pháp hoá học để phân biệt ba khí: etan, etilen và cacbon đioxit.
 Xem đáp án
Xem đáp án
Thử với nước brom, khí nào làm mất màu nước brom là etilen :
C2H4 + Br2 → C2H4Br2
Hai khí còn lại đem thử với nước vôi trong; chất nào làm dung dịch vẩn dục là CO2:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Câu 8:
Hỗn hợp khí A chứa một ankan và một anken, Khối lượng hỗn hợp A là 9 gam và thể tích là 8,96 lít. Đốt cháy hoàn toàn A, thu được 13,44 lít CO2. Các thể tích được đo ở đktc.
Xác định công thức phân tử và phần trăm thể tích từng chất trong A.
 Xem đáp án
Xem đáp án
Khối lượng trung bình của 1 mol A :
Trong hỗn hợp A phải có chất có M < 22,5 ; chất đó chỉ có thể là CH4.
Sau đó giải hệ
Ta tìm được m = 3; x = 0,3; y = 0,1.
Câu 9:
0,7 g một anken có thể làm mất màu 16,0 g dung dịch brom (trong CCl4) có nồng độ 12,5%.
1. Xác định công thức phân tử chất A.
2. Viết công thức cấu tạo của tất cả các đồng phân cấu tạo ứng với công thức phân tử tìm được. Ghi tên từng đồng phân.
 Xem đáp án
Xem đáp án
1. CnH2n + Br2 → CnH2nBr2
Số mol anken = số mol Br2
Khối lượng 1 mol anken
14n = 56 ⇒ n = 4 ⇒ C4H8.
2. Công thức cấu tạo
CH2 = CH - CH2 - CH3 (but-1-en);
CH3 - CH = CH - CH3 (but-2-en)
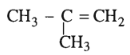

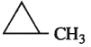
Câu 10:
Hỗn hợp khí A chứa eten và hiđro. Tỉ khối của A đối với hiđro là 7,5. Dẫn A đi qua chất xúc tác Ni nung nóng thì A biến thành hỗn hợp khí B có tỉ khối đối với hiđro là 9,0.
Tính hiệu suất phản ứng cộng hiđro của eten.
 Xem đáp án
Xem đáp án
Giả sử trong 1 mol hỗn hợp A có x mol C2H4 và (1-x) mol H2.
MA = 28x + 2(1 - x) = 7,5.2 = 15 (g/mol) ;
⇒ x = 0,5.
Giả sử khi dẫn 1 mol A qua chất xúc tác Ni, có n mol C2H4 tham gia phản ứng :
C2H4 + H2 → C2H6
n mol n mol n mol
Số mol khí còn lại trong hỗn hợp B là (1-n) mol. Theo định luật bảo toàn khối lượng :
mB = mA= 15 g.
Khối lượng của 1 mol B:
Hiệu suất phản ứng:
Câu 11:
Hỗn hợp khí A chứa hiđro và một anken. Tỉ khối của A đối với hiđro là 6,0. Đun nóng nhẹ hỗn hợp A có mặt chất xúc tác Ni thì A biến thành hỗn hợp khí B không làm mất màu nước brom và có tỉ khối đối với hiđro là 8,0.
Xác định công thức phân tử và phần trăm thể tích của từng chất trong hỗn hợp A và hỗn hợp B.
 Xem đáp án
Xem đáp án
Giả sử trong 1 mol A có x mol CnH2n và (1 - x) mol H2.
MA = 14nx + 2(1 - x) = 2.6 = 12 (g/mol) (1)
Khi đun nóng 1 mol A có mặt chất xúc tác Ni, tất cả anken đã chuyển hết thành ankan (vì B không làm mất màu nước brom).
CnH2n + H2 → CnH2n+2
x mol x mol x mol
Số mol khí trong hỗn hợp B là (1 - x)
Khối lượng hỗn hợp B = khối lượng hỗn hợp A = 12 (g). Do đó :
Thay x = 0,25 vào (1), tìm được n = 3.
Hỗn hợp A: C3H6 25%; H2: 75%.
Hỗn hơp B: C3H8:
H2: 66,67%.
Câu 12:
Hỗn hợp khí A chứa hiđro và 2 anken kế tiếp nhau trong dãy đồng đẳng. Tỉ khối của A đối với hiđro là 8,26. Đun nóng nhẹ hỗn hợp A có mặt chất xúc tác Ni thì A biến thành hỗn hợp khí B không làm mất màu nước brom và có tỉ khối đối với hiđro là 11,80.
Xác định công thức phân tử và phần trăm thể tích của từng chất trong hỗn hợp A và hỗn hợp B.
 Xem đáp án
Xem đáp án
Trong 1 mol A có x mol 2 anken (có công thức chung là Cn−H2n−) và (1-x) mol H2:
MA = 14n−x + 2(1 - x) = 8,26.2 = 16,52 (g/mol). (1)
Thay x = 0,3 vào (1), tìm được n = 3,6.
Công thức của 2 anken là C3H6 (a mol) và C4H8 (b mol)
Hỗn hợp A: C3H6: 12%; C4H8: 18%; H2: 70%.
Hỗn hợp B: C3H8:
C4H10:
H2 chiếm 57%.
Câu 13:
Hỗn hợp khí A chứa hiđro, một ankan và một anken. Dẫn 13,44 lít A đi qua chất xúc tác Ni nung nóng thì thu được 10,08 lít hỗn hợp khí B. Dẫn B đi qua bình đựng nước brom thì màu của dung dịch nhạt đi, khối lượng của bình tăng thêm 3,15 g. Sau thí nghiệm, còn lại 8,4 lít hỗn hợp khí C có tỉ khối đối với hiđro là 17,80. Biết các thể tích được đo ở đktc và các phản ứng đều xảy ra hoàn toàn.
Xác định công thức phân tử và phần trăm thể tích của từng chất trong mỗi hỗn hợp A, B và C.
 Xem đáp án
Xem đáp án
Số mol khí trong hỗn hợp A là
trong B là
và trong C là
A chứa H2, CnH2n+2 và CmH2m. Khi A đi qua chất xúc tác Ni:
CmH2m + H2 → CmH2m+2
B chứa CnH2n+2, CmH2m+2 và CmH2 ra còn dư.
Số mol H2 trong A là: 0,6 - 0,45 = 0,15 (mol).
Đó cũng là số mol CmH2m+2 trong B.
Khi B đi qua nước brom thì CmH2m bị giữ lại:
CmH2m + Br2 → CmH2mBr2.
Số mol CmH2m trong B là: 0,45 - 0,375 = 0,075 (mol).
Khối lương 1 mol
Anken là C3H6 và ankan do chất đó tạo ra là C3H8.
Trong hỗn hợp c có 0,15 mol C3H8 và 0,375 - 0,15 = 0,225 mol CnH2n+2
Khối lượng hỗn hợp C là: 0,375. 17,8. 2 = 13,35 (g).
⇒ 0,15.44 + 0,225(14n + 2) = 13,35
⇒ n = 2 Ankan là C2H6.
A chứa C2H6 (37,5%); C3H6 (37,5%) và H2 (25%) ;
B chứa C2H6 (50%); C3H8 (33,3%) và C3H6 (16,7%); C chứa C2H6 (60%) và C3H8 (40%).
Câu 14:
Hỗn hợp khí A chứa hiđro, một ankan và một anken. Đốt cháy hoàn toàn 100 ml A, thu được 210 ml khí CO2. Nếu đun nóng nhẹ 100 ml A có mặt chất xúc tác Ni thì còn lại 70 ml một chất khí duy nhất. Các thể tích khí đều đo ở cùng một điều kiện.
1. Xác định công thức phân tử và phần trăm thể tích của từng chất trong hỗn hợp A.
2. Tính thể tích oxi vừa đủ để đốt cháy hoàn toàn 100 ml A.
 Xem đáp án
Xem đáp án
1. Khi đun nóng A có mặt chất xúc tác Ni, chỉ còn lại 1 chất khí duy nhất. Vậy ankan và anken trong A có cùng số nguyên tử cacbon.
Giả sử trong 100 ml A có x mol CnH2n+2; y mol CnH2n và z mol H2.
x + y + z = 100 (1)
Khi đốt cháy hoàn toàn 100 ml A :
2H2 + O2 → 2H2O
Thể tích CO2: n(x + y) = 210 (2)
Khi đun nóng A có mặt chất xúc tác Ni:
x + y = 70 (3)
y = z (4)
Giải hộ phương trình, tìm được n = 3; x = 40 ; y = z = 30.
Thành phần thể tích của hỗn hợp A là : C3H8: 40% ; C3H6: 30%; H2 : 30%
2. Thể tích O2 là 350 ml.