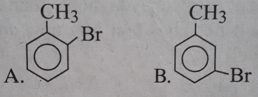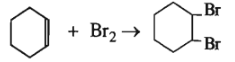Giải SBT Hóa học 11 Chương 7: Hidrocacbon thơm. Nguồn hidrocacbon thiên nhiên. Hệ thống hóa về hidrocacbon
Bài 36: Luyện tập: Hiđrocacbon thơm - SBT Hóa học 11
-
1066 lượt thi
-
9 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
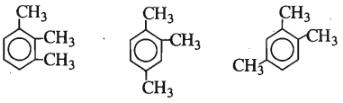
Có bốn tên gọi : o-xilen, o-đimetylbenzen, 1,2-đimetylbenzen, etylbenzen. Đó là tên của
 Xem đáp án
Xem đáp án
Đáp án: B.
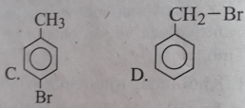
Câu 4:
Nếu cho toluen tác dụng với brom trong điều kiện chiếu sáng và đun nóng nhẹ, sản phẩm chính là
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 5:
Cho vào ống nghiệm 2 ml nước brom. Nhỏ từ từ vào ống nghiệm đó 1 ml benzen. Trong ống nghiệm có 2 lớp chất lỏng : lớp dưới có thể tích lớn hơn và có màu vàng nâu, lớp trên không màu. Lắc kĩ ống nghiệm để hai lớp đó trộn vào nhau và sau đó để yên ống nghiệm. Trong ống lại thấy 2 lớp chất lỏng : lớp dưới có thể tích lớn hơn và không màu, lớp trên có màu.
Hãy giải thích những hiện tượng vừa nêu.
 Xem đáp án
Xem đáp án
Benzen là chất lỏng không màu, nhẹ hơn nước, không tan trong nước nên nổi lên trên nước brom (nước brom có màu vàng nâu).
Khi lắc ống, vì benzen hoà tan brom tốt hơn nước nên brom chuyển từ nước brom sang dung dịch brom trong benzen. Vì thế khi để yên ống nghiệm, lớp dưới không màu và lớp trên có màu nâu.
Câu 6:
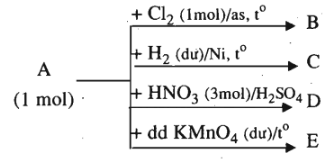
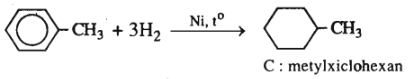
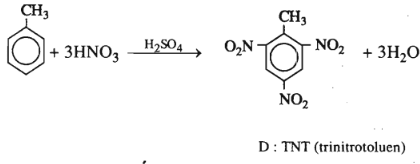
A là một đồng đẳng của benzen có tỉ khối hơi so với metan bằng 5,75.
A tham gia các quá trình chuyển hóa theo sơ đồ sau:
Trên sơ đồ chỉ ghi các chất sản phẩm hữu cơ (phản ứng còn có thể tạo ra các chất vô cơ).
Hãy viết phương trình hóa học của các quá trình chuyển hóa. Các chất hữu cơ viết dưới dạng công thức cấu tạo, kèm theo tên gọi.
 Xem đáp án
Xem đáp án
MA = 5,75 x 16,0 = 92,0(g/mol)
⇒ 14n - 6 = 92 ⇒ n = 7
A là C7H8 hay C6H5-CH3 (toluen)
C6H5-CH3 + Cl2 C6H5CH2Cl + HCl (B: benzyl clorua)
C6H5-CH3 + 2KMnO4 C6H5-COOK + KOH + 2MnO2 + H2O (E: kali benzoat)
Câu 7:
Chất A là một đồng đẳng của benzen. Khi đốt cháy hoàn toàn 1,5 g chất A, người ta thu được 2,52 lít khí CO2 ( ở đktc ).
1. Xác định công thức phân tử chất A.
2. Viết các công thức cấu tạo có thể có của A kèm theo tên tương ứng.
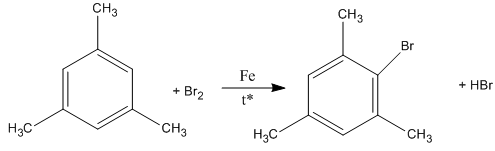
3. Khi A tác dụng với Br2 có chất xúc tác Fe và nhiệt độ thì một nguyên tử H đính với vòng benzen bị thay thế bởi Br, tạo ra dẫn xuất monobrom duy nhất. Xác định công thức cấu tạo đúng của A.
 Xem đáp án
Xem đáp án
Cứ ( 14n - 6) g A tạo ra n mol C02
Cứ 1,50 g A tạo ra
Công thức phân tử của A là C9H12
2. Các công thức cấu tạo
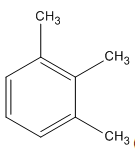
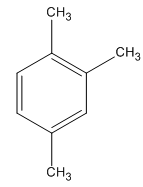
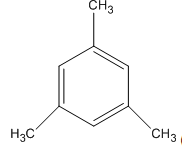
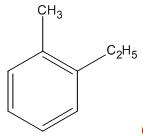
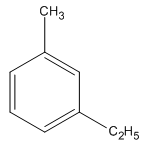
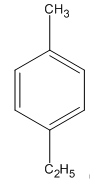
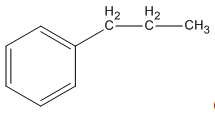
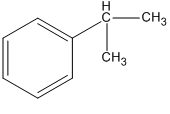
3.
Câu 8:
Hỗn hợp M chứa benzen và xiclohexen. Hỗn hợp M có thể làm mất màu tối đa 75,0 g dung dịch brom 3,2%. Nếu đốt cháy hoàn toàn hỗn hợp M và hấp thụ tất cả sản phẩm cháy vào dung dịch Ca(OH)2 (lấy dư) thì thu được 21 g kết tủa. Tính phần trăm khối lượng từng chất trong hỗn hợp M.
 Xem đáp án
Xem đáp án
Benzen không cộng hợp với brom trong nước brom.
Xiclohexen có phản ứng:
Số mol xiclohexen = số mol Br2
Đặt số mol benzen trong hỗn hợp M là x.
2C6H6 + 15O2 → 12CO2 + 6H2O
x mol 6x mol
2C6H10 + 17O2 → 12CO2 + 10H2O
015 mol 0,09 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
6x + 0,09 = 0,210 ⇒ x = 0,02
Khối lượng hỗn hợp M là : 0,02.78 + 0,015.82 = 2,79 (g).
% về khối lượng của C6H6 là:
⇒ C6H10 chiếm 44,1% khối lượng hỗn hợp M.
Câu 9:
Hỗn hợp A gồm hiđro và hơi benzen. Tỉ khối của A so với metan là 0,6. Dẫn A đi qua chất xúc tác Ni nung nóng thì chỉ xảy ra phản ứng làm cho một phần benzen chuyển thành xiclohexan. Hỗn hợp sau phản ứng có tỉ khối hơi so với metan là 0,75.
Tính xem bao nhiêu phần trăm benzen đã chuyển thành xiclohexan.
 Xem đáp án
Xem đáp án
Giả sử trong 1 mol hỗn hợp A có X mol C6H6 và (1 - x) mol H2.
MA = 78x + 2(1 - x) = 0,6.16 = 9,6 (g/mol)
⇒ x = 0,1
Vậy trong 1 mol A có 0,1 mol C6H6 và 0,9 mol H2.
Nếu cho 1 mol A qua chất xúc tác Ni, có n mol C6H6 phản ứng :
C6H6 + 3H2 → C6H12
n mol 3n mol n mol
Số mol khí còn lại là (1 - 3n) nhưng khối lượng hỗn hợp khí vẫn là 9,6 (g). Vì vậy, khối lượng trung bình của 1 mol khí sau phản ứng :
Tỉ lệ C6H6 tham gia phản ứng :