Giải SGK Hoá học 11 Kết nối tri thức Bài 2: Cân bằng trong dung dịch nước có đáp án
Giải SGK Hoá học 11 Kết nối tri thức Bài 2: Cân bằng trong dung dịch nước có đáp án
-
132 lượt thi
-
18 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Hình 2.1 cho thấy giá trị pH của dung dịch một số chất thông dụng. Vậy pH là gì? pH có ảnh hưởng gì đến đời sống? Xác định pH như thế nào?

 Xem đáp án
Xem đáp án
pH là một đại lượng liên hệ trực tiếp với nồng độ H+ để đánh giá tính acid, base của một dung dịch đã cho, với quy ước như sau:
pH = -log[H+] hoặc [H+] = 10-pH
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ con người, sự phát triển của động, thực vật, …
Ví dụ:
+ Cá ưa sống trong môi trường nước có pH khoảng 7,5 – 8,5.
+ Một số loại thực vật chỉ phát triển tốt trong đất có giá trị pH thích hợp.
Câu 2:
Thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn được thực hiện như mô tả trong Hình 2.2.
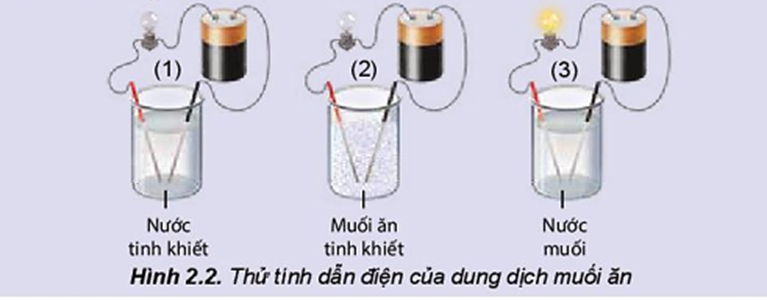
Thực hiện yêu cầu:
a) Hãy nhắc lại khái niệm dòng điện.
b) Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là loại hạt nào (electron, phân tử NaCl, cation hay anion)?
c) Hãy giải thích sự tạo thành các hạt mang điện đó.
 Xem đáp án
Xem đáp án
a) Dòng điện là dòng dịch chuyển có hướng của các hạt mang điện.
b) Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ dung dịch có hạt mang điện. Đó có thể là cation và anion.
c) Giải thích:
NaCl là hợp chất ion, trong tinh thể có các ion Na+ và Cl- liên kết với nhau bằng lực hút tĩnh điện. Nước là một dung môi phân cực. Khi cho tinh thể NaCl vào nước, các ion Na+ và Cl- trên bề mặt hút các phân tử nước lại gần. Các phân tử nước hướng các đầu âm vào ion Na+, các đầu dương vào ion Cl- và làm yếu liên kết giữa các cation, anion trong tinh thể và khuếch tán vào nước.
Câu 3:
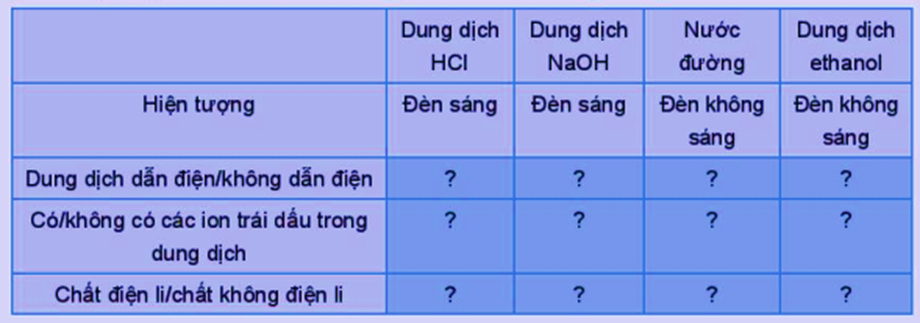
Kết quả thử tính dẫn điện với các dung dịch hydrochloric acid (HCl), sodium hydroxide (NaOH), saccharose (C12H22O11), ethanol (C2H5OH) được trình bày trong bảng dưới đây. Hãy hoàn thành các thông tin còn thiếu trong bảng vào vở:
 Xem đáp án
Xem đáp án
|
|
Dung dịch HCl |
Dung dịch NaOH |
Nước đường |
Dung dịch ethanol |
|
Hiện tượng |
Đèn sáng |
Đèn sáng |
Đèn không sáng |
Đèn không sáng |
|
Dung dịch dẫn điện/không dẫn điện |
Dung dịch dẫn điện |
Dung dịch dẫn điện |
Dung dịch không dẫn điện |
Dung dịch không dẫn điện |
|
Có/không có các ion trái dấu trong dung dịch |
Có ion trái dấu trong dung dịch |
Có ion trái dấu trong dung dịch |
Không có ion trái dấu trong dung dịch |
Không có ion trái dấu trong dung dịch |
|
Chất điện li/chất không điện li |
Chất điện li |
Chất điện li |
Chất không điện li |
Chất không điện li |
Câu 4:
Kết quả thử tính dẫn điện với dung dịch HCl 0,1 M và dung dịch CH3COOH 0,1 M cho thấy trường hợp cốc đựng dung dịch HCl 0,1 M bóng đèn sáng hơn.
Thực hiện yêu cầu sau:
Hãy so sánh số ion mang điện trong hai dung dịch trên, từ đó cho biết acid nào phân li mạnh hơn.
 Xem đáp án
Xem đáp án
Hai dung dịch HCl và CH3COOH có cùng nồng độ là 0,1 M. Trường hợp cốc đựng dung dịch HCl 0,1 M bóng đèn sáng hơn => số hạt mang điện trong dung dịch HCl nhiều hơn số hạt mang điện trong dung dịch CH3COOH 0,1 M.
Vậy acid HCl phân li mạnh hơn.
Câu 5:
Viết phương trình điện li của các chất sau: HF, HI, Ba(OH)2, KNO3, Na2SO4.
 Xem đáp án
Xem đáp án
Phương trình điện li:
HF ⇌ H+ + F-
HI → H+ + I-
Ba(OH)2 → Ba2+ + 2OH-
KNO3 → K+ + NO3-
Na2SO4 → 2Na+ +
Câu 6:
Cho các dung dịch: HCl, NaOH, Na2CO3.
a) Viết phương trình điện li của các chất trên.
 Xem đáp án
Xem đáp án
a) Phương trình điện li của các chất:
HCl → H+ + Cl-
NaOH → Na+ + OH-
Na2CO3 → 2Na+ +
Câu 7:
b) Sử dụng máy đo pH (hoặc giấy pH) xác định pH, môi trường (acid/base) của các dung dịch trên.
 Xem đáp án
Xem đáp án
b) Học sinh sử dụng máy đo xác định pH, tham khảo kết quả sau:
|
Dung dịch |
HCl (0,01 M) |
NaOH (0,01 M) |
Na2CO3 (0,01 M) |
|
pH |
2 |
12 |
11,17 |
|
Môi trường |
acid |
base |
base |
Câu 8:
c) Theo khái niệm acid – base trong môn Khoa học tự nhiên ở lớp 8, trong những chất cho ở trên: Chất nào là acid? Chất nào là base?
 Xem đáp án
Xem đáp án
c) Trong môn Khoa học tự nhiên 8:
- Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
- Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH-.
=> Theo khái niệm acid – base trong môn Khoa học tự nhiên ở lớp 8, HCl là acid; NaOH là base.
Câu 9:
Dựa vào thuyết acid – base của Br∅nsted – Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau:
a) CH3COOH + H2O ⇌ CH3COO- + H3O+
b) S2- + H2O ⇌ HS- + OH-
 Xem đáp án
Xem đáp án
Thuyết Br∅nsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
a) CH3COOH + H2O ⇌ CH3COO- + H3O+
Trong phản ứng trên: CH3COOH cho H+, CH3COOH là acid; H2O nhận H+, H2O là base.
b) S2- + H2O ⇌ HS- + OH-
Trong phản ứng trên: H2O cho H+, H2O là acid; S2- nhận H+, S2- là base.
Câu 10:
Một loại dầu gội đầu có nồng độ ion OH- là 10-5,17 mol/ L.
a) Tính nồng độ ion H+, pH của loại dầu gội nói trên.
b) Môi trường của loại dầu gội trên là acid, base hay trung tính?
 Xem đáp án
Xem đáp án
a) Ta có: [H+].[OH]- = 10-14
Ta có: pH = -log[H+] = 8,83.
b) pH > 7 nên môi trường của loại dầu gội trên là base.
Câu 11:
Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy đo pH đo được giá trị pH là 4,52.
a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp để giảm độ chua, tăng độ pH của đất.
 Xem đáp án
Xem đáp án
a) Giá trị pH là 4,52 < 7 nên môi trường của dung dịch là acid.
b) Biện pháp để giảm độ chua, tăng độ pH của đất:
+ Xây dựng hệ thống tưới, tiêu nước để rửa chua cho đất.
+ Sử dụng vôi bột, tro bếp … bón cho đất.
+ Bón phân hữu cơ, phân chuồng ủ hoai mục … cho đất (cách này giúp giảm pH của đất một cách từ từ, nếu muốn giảm pH của đất một cách nhanh chóng thì cách này không phù hợp).
Câu 12:
pH của dung dịch nào sau đây có giá trị nhỏ nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
|
Dung dịch |
HCl 0,1 M |
CH3COOH 0,1 M |
NaCl 0,1 M |
NaOH 0,01 M |
|
pH |
1 |
> 1 |
7 |
12 |
Câu 13:
Đo PH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
pH = 2,4 < 7 Þ Nước chanh có môi trường acid (loại A).
[H+] của nước chanh là 10-pH = 10-2,4 (loại B).
[OH-] của nước chanh là 10-11,6 < 10-7 (loại D).
Câu 14:
Nước Javel (chứa NaClO và NaCl) được dùng làm chất tẩy rửa, khử trùng. Trong dung dịch, ion ClO- nhận proton của nước để tạo thành HClO.
a) Viết phương trình hoá học của phản ứng xảy ra và xác định chất nào là acid, chất nào là base trong phản ứng trên.
b) Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base.
 Xem đáp án
Xem đáp án
a) Phương trình hoá học của phản ứng xảy ra:
ClO- + H2O ⇌ HClO + OH-
Trong phản ứng trên ClO- nhận H+ từ nước nên là base; H2O là acid.
b) Dựa vào phản ứng ta thấy môi trường của nước Javel là môi trường base.
Câu 15:
Chuẩn bị:
- Hoa đậu biếc (khoảng 50 g) hoặc bắp cải tím thái nhỏ (khoảng 100 g).
- Cốc thuỷ tinh 250 mL, nước sôi, đũa thuỷ tinh, lưới/ vải lọc.
- Các cốc (đã được dán nhãn) đựng giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối.
- Giấy pH hoặc máy đo pH.
Tiến hành:
– Ngâm khoảng 50 g hoa đậu biếc/100 g bắp cải tím đã được chuẩn bị vào 100 mL nước sôi trong khoảng 10 phút. Lọc bằng lưới lọc hoặc vải lọc, thu được dung dịch. Dung dịch này được sử dụng làm chất chỉ thị.
– Dùng máy đo pH (hoặc giấy pH) xác định pH của các dung dịch.
- Cho vài giọt chất chỉ thị lần lượt vào các dung dịch: giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối và khuấy đều. Quan sát sự đổi màu của các dung dịch.
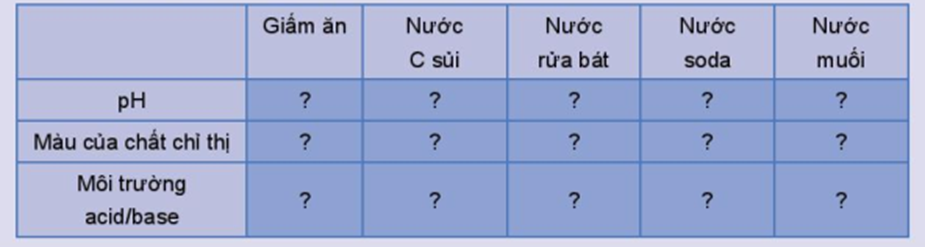
Hoàn thành thông tin theo mẫu bảng sau vào vở:
 Xem đáp án
Xem đáp án
|
|
Giấm ăn |
Nước C sủi |
Nước rửa bát |
Nước soda |
Nước muối |
|
pH |
3 |
3,5 |
9,5 |
3,8 |
7 |
|
Màu của chất chỉ thị |
Đỏ tím |
Đỏ tím |
Xanh vàng |
Đỏ tím |
Không đổi màu |
|
Môi trường acid/ base |
Acid |
Acid |
Base |
Acid |
Trung tính |
Câu 16:
Cho các dung dịch sau: Na2CO3, AlCl3, FeCl3.
1. Dùng giấy pH xác định giá trị pH gần đúng của các dung dịch trên.
2. Nhận xét và giải thích về môi trường của các dung dịch trên.
 Xem đáp án
Xem đáp án
1.
Học sinh dùng giấy pH xác định giá trị pH gần đúng của các dung dịch. Tham khảo:
|
Dung dịch |
Na2CO3 |
AlCl3 |
FeCl3 |
|
pH gần đúng |
11 |
3 |
1,5 |
2. Giải thích:
- Trong dung dịch Na2CO3, ion Na+ không bị thuỷ phân, còn ion thuỷ phân trong nước tạo ra ion OH- theo phương trình:
Vậy dung dịch Na2CO3 có môi trường base.
- Trong dung dịch AlCl3 và FeCl3, ion Cl- không bị thuỷ phân, các ion Al3+ và Fe3+ bị thuỷ phân trong nước tạo ra ion H+ theo phương trình ở dạng đơn giản như sau:
Al3+ + H2O ⇌ Al(OH)2+ + H+
Fe3+ + H2O ⇌ Fe(OH)2+ + H+
Vậy các dung dịch AlCl3 và FeCl3 có môi trường acid.
Câu 17:
Nêu một số điểm cần chú ý trong quá trình chuẩn độ.
 Xem đáp án
Xem đáp án
Một số điểm cần lưu ý trong quá trình chuẩn độ:
- Tránh để các hoá chất như dung dịch HCl, dung dịch NaOH bắn vào tay, mắt.
- Các dụng cụ thuỷ tinh (bình tam giác, burette, pipette …) dễ vỡ, cần cẩn thận.
Câu 18:
Nêu một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ.
 Xem đáp án
Xem đáp án
Một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ:
+ Sai số do phương pháp hay quy trình chuẩn độ: phản ứng hoá học không hoàn toàn, chỉ thị đổi màu khi chưa đến điểm tương đương …
+ Sai số do dụng cụ như: dụng cụ chưa được rửa sạch, dụng cụ chưa được chuẩn hoá…
+ Sai số do người làm thí nghiệm: mắt nhìn không chính xác, cẩu thả trong thực nghiệm …
+ Sai số do hoá chất không tinh khiết.
