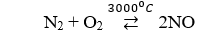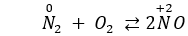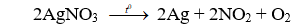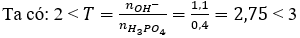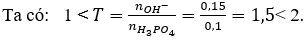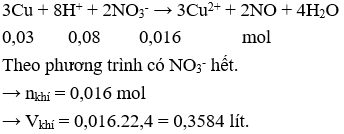Đề thi giữa kì 1 Hóa 11 có đáp án (Trắc nghiệm - Bài số 2 - Đề 3)
-
1094 lượt thi
-
24 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Ở (hoặc có tia lửa điện) hoá hợp với theo phương trình phản ứng nào sau đây
 Xem đáp án
Xem đáp án
Chọn A
Câu 2:
Có thể dùng bình đựng đặc, nguội bằng kim loại nào ?
 Xem đáp án
Xem đáp án
Chọn C
Sắt, nhôm bị thụ động hóa trong đặc, nguội nên có thể dùng bình bằng những kim loại này để chứa đặc, nguội.
Câu 4:
Cho các dung dịch: ,
 Xem đáp án
Xem đáp án
Chọn B
Dùng
+ Có khí mùi khai thoát ra và xuất hiện kết tủa trắng →
+ Có kết tủa keo trắng, khi cho đến dư kết tủa tan →
Câu 6:
Chọn cấu hình electron lớp ngoài cùng của nguyên tố nhóm VA?
 Xem đáp án
Xem đáp án
Chọn đáp án B
- Nhóm VA có 5 electron lớp ngoài cùng. Cấu hình electron lớp ngoài cùng có dạng: ns2np3.
- Số electron hóa trị của các nguyên tố nhóm A bằng số electron lớp ngoài cùng.
⇒ Số electron hóa trị của nguyên tố nhóm VA là 5 electron.
Câu 8:
Trong phản ứng nào sau đây, nitơ thể hiện tính khử ?
 Xem đáp án
Xem đáp án
Chọn C
Số oxi hóa của N tăng từ 0 lên +2. Vậy thể hiện tính khử.
Câu 9:
Trong thí nghiệm đồng tác dụng với dung dịch đặc để tránh khí độc bay ra người ta thường nút ống nghiệm bằng bông có tẩm dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Chọn B
Câu 12:
Hiện tượng xảy ra khi cho giấy quỳ khô vào bình đựng khí amoniac là
 Xem đáp án
Xem đáp án
Chọn D
Khí không làm đổi màu giấy quỳ khô.
Câu 13:
Nồng độ ion trong nước uống tối đa cho phép là 9 ppm. Nếu thừa ion sẽ gây một loại bệnh thiếu máu hoặc tạo thành nitrosamin, một hợp chất gây ung thư đường tiêu hóa. Để nhận biết ion , người ta dùng:
 Xem đáp án
Xem đáp án
Chọn C
Để nhận ra dùng Cu và . Hiện tượng: Cu tan dần, dung dịch sau phản ứng có màu xanh, thoát ra khí không màu hóa nâu trong không khí.
Câu 14:
Cần lấy bao nhiêu lít khí để điều chế được 67,2 lít khí amoniac ? Biết rằng thể tích của các khí được đo trong cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%.
 Xem đáp án
Xem đáp án
Chọn D
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ về thể tích cũng là tỉ lệ về số mol.
Câu 15:
Hòa tan 32 g hỗn hợp Cu và CuO trong dung dịch 1M (dư), thoát ra 6,72 lít khí NO (đktc). Khối lượng CuO trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Chọn D
Câu 16:
Cho 44g NaOH vào dung dịch chứa 39,2g Sau khi phản ứng xảy ra hoàn toàn , đem cô dung dịch thu được đến cạn khô. Hỏi những muối nào được tạo nên và khối lượng muối khan thu được là bao nhiêu ?
 Xem đáp án
Xem đáp án
Chọn D
Vậy sau phản ứng thu được hai muối (x mol) và (y mol)
Bảo toàn Na có: 2x + 3y = 1,1 (1)
Bảo toàn C có: x + y = 0,4 (2)
Từ (1) và (2) có x = 0,1 và y = 0,3 mol
Vậy khối lượng và lần lượt là 14,2 gam và 49,2 gam.
Câu 17:
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của?
 Xem đáp án
Xem đáp án
Chọn B
Độ dinh dưỡng của phân lân được tính bằng hàm lượng % của
Câu 18:
Chọn phát biểu đúng?
 Xem đáp án
Xem đáp án
Chọn B
A sai vì photpho trắng độc.
C sai vì photpho trắng hoạt động mạnh hơn photpho đỏ.
D sai vì Photpho trắng phát quang màu lục nhạt trong bóng tối.
Câu 19:
Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol . Sau phản ứng, trong dung dịch có muối nào ?
 Xem đáp án
Xem đáp án
Chọn A
Vậy sau phản ứng thu được hai muối
Câu 20:
Cho m(g) Al tan hoàn toàn trong dung dịch thấy tạo ra 11,2 lít (đktc) hỗn hợp 3 khí NO, với tỷ lệ mol tương ứng là 1: 2 : 2. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn C
Gọi số mol của NO là a mol → số mol của là 2a mol; số mol là 2a mol.
Câu 21:
Hòa tan hết m(g) Al trong dung dịch thu được hỗn hợp khí (đktc) gồm NO và có thể tích là 8,96 lít và có tỷ khối đối với hiđro là 16,75. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn D
Câu 22:
Hoà tan hoàn toàn 19,2 gam một kim loại M trong dung dịch ta thu được 4,48 lít NO (đktc). Kim loại M là
 Xem đáp án
Xem đáp án
Chọn D
Bảo toàn electron có: 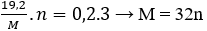
Vậy n = 2; M = 64 thỏa mãn. Kim loại cần tìm là Cu.