Đề thi Hóa 11 giữa kì 1 có đáp án (Đề 8)
-
5253 lượt thi
-
31 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Dung dịch chất nào sau đây không dẫn điện?
 Xem đáp án
Xem đáp án
Đáp án A
Khi tan trong nước các dung dịch: CuSO4, NaCl, KBr có khả năng phân li ra ion.
CH3OH trong dung dịch không có khả năng phân li ion nên không dẫn điện.
Câu 2:
Chất nào sau đây là chất điện li yếu?
 Xem đáp án
Xem đáp án
Đáp án C
Chất điện li yếu: CH3COOH.
Phương trình điện li: CH3COOHCH3COO-+ H+
Câu 3:
Sự điện li là
 Xem đáp án
Xem đáp án
Đáp án B
Sự điện li là sự phân li các chất thành ion khi tan trong nước.
Câu 4:
Phương trình điện li viết đúng là
 Xem đáp án
Xem đáp án
Đáp án D
Phương trình điện li viết đúng là Ca(OH)2→ Ca2++ 2OH-
A sai vì NaCl → Na++ Cl-
B sai vì CH3COOH là chất điện li yếu.
C sai vì C2H5OH là chất không điện li.
Câu 5:
Các dung dịch sau đây có cùng nồng độ 1M, dung dịch nào dẫn điện tốt nhất
 Xem đáp án
Xem đáp án
Đáp án B
Dung dịch có nồng độ các ion càng lớn thì độ dẫn điện càng tốt.
Nồng độ mol các dung dịch là 1M.
Ý A. NH4NO3 → NH4+ + NO3–suy ra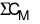 ion = 2M.
ion = 2M.
Ý B. Al2(SO4)3 → 2Al3+ + 3SO42– suy ra 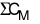 ion = 5M.
ion = 5M.
Ý C. Ba(OH)2 → Ba2+ + 2OH– suy ra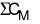 ion = 3M.
ion = 3M.
Ý D. H2SO4 → 2H+ + SO42– suy ra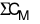 ion = 3M.
ion = 3M.
Vậy dung dịch Al2(SO4)3 dẫn điện tốt nhất
Câu 6:
Theo thuyết Areniut thì chất nào sau đây là bazơ?
 Xem đáp án
Xem đáp án
Đáp án C
Theo thuyết Areniut thì bazơ là chất khi tan trong nước phân li ra OH-.
Vậy chất là bazơ là: LiOH
Câu 7:
Đối với dung dịch axit mạnh HNO30,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án A
HNO3 là một axit mạnh nên khi hòa tan trong nước bị phân li hoàn toàn thành ion.
HNO3→ H++ NO3-
Vậy [H+] = 0,1M.
Câu 8:
Nồng độ mol của anion Cl-trong dung dịch FeCl30,45M là
 Xem đáp án
Xem đáp án
Đáp án C

Vậy nồng độ mol của anion Cl-trong dung dịch FeCl30,45M là 1,35M.
Câu 9:
Chất nào sau đây không có tính lưỡng tính?
 Xem đáp án
Xem đáp án
Đáp án B
Chất không có tính lưỡng tính là: Na2CO3.
Na2CO3→ 2Na++ CO32-
Câu 10:
Dung dịch NaOH 0,01M có pH bằng:
 Xem đáp án
Xem đáp án
Đáp án D
NaOH là chất điện li mạnh suy ra [OH-] = CM(NaOH)= 0,01M
⇒ pOH = -log[OH-] = -log(0,01) = 2
⇒ pH = 14 - pOH = 14 - 2 = 12
Câu 11:
Phương trình ion rút gọn của phản ứng cho biết
 Xem đáp án
Xem đáp án
Đáp án C
Phương trình ion rút gọn của phản ứng cho biết: Bản chất của phản ứng trong dung dịch các chất điện li
Câu 12:
Phản ứng hóa học nào sau đây có phương trình ion rút gọn: H+ + OH- H2O
 Xem đáp án
Xem đáp án
Đáp án A
KOH + HNO3 KNO3 + H2O
Có phương trình ion rút gọn: H+ + OH- H2O
Câu 13:
Cặp dung dịch nào sau đây phản ứng với nhau không tạo thành kết tủa?
 Xem đáp án
Xem đáp án
Đáp án D
2NaOH + H2SO4→ Na2SO4+ 2H2O
Câu 14:
Các dung dịch NaCl, NaOH, NH3, Ba(OH)2có cùng nồng độ mol. Giá trị pH của các dung dịch được sắp xếp theo chiều tăng dần từ trái sang phải là:
 Xem đáp án
Xem đáp án
Đáp án B
+ NaCl: môi trường trung tính, NH3: bazơ yếu, NaOH, Ba(OH)2: bazơ mạnh và giá trị pH tỉ lệ thuận với nồng độ OH- suy ra chất càng phân li ra nhiều OH- thì chất đó có pH càng lớn
+ Giá trị pH của các dung dịch được sắp xếp theo chiều tăng dần từ trái sang phải là: NaCl, NH3, NaOH, Ba(OH)2
Câu 15:
Muối nào sau đây là muối axit?
 Xem đáp án
Xem đáp án
Đáp án A
+ Muối axit là muối mà gốc axit còn H có khả năng phân li ra H+
+ Trong các muối đã cho, muối axit là: NaHSO4.
NaHSO4→ Na++ HSO4-
HSO4-→ H++ SO42-
Câu 16:
Dung dịch nào dưới đây dùng để phân biệt dung dịch KCl với dung dịch K2SO4?
 Xem đáp án
Xem đáp án
Đáp án C
Sử dụng BaCl2:
+ K2SO4phản ứng với BaCl2 tạo kết tủa trắng.
K2SO4+ BaCl2→ 2KCl + BaSO4 (↓)
+ KCl không phản ứng với BaCl2
Câu 17:
Khí nitơ tương đối trơ ở nhiệt độ thường là do
 Xem đáp án
Xem đáp án
Đáp án D
Khí nitơ tương đối trơ ở nhiệt độ thường là do trong nguyên tử N2có liên kết ba bền.
Câu 18:
Cặp công thức của liti nitrua và nhôm nitrua là
 Xem đáp án
Xem đáp án
Đáp án C
+ Khi liên kết với kim loại nitơ dễ nhận thêm 3e (nên có số oxi hóa -3); còn Li dễ nhường 1e và Al dễ nhường 3e (nên lần lượt có số oxi hóa là +1 và +3)
+ Cặp công thức của liti nitrua và nhôm nitrua là Li3N và AlN.
Câu 19:
Cho vài giọt phenolphtalein vào dung dịch NH3thì dung dịch chuyển thành
 Xem đáp án
Xem đáp án
Đáp án B
Dung dịch NH3 là bazơ làm hồng phenolphtalein.
Câu 20:
Khí không màu hóa nâu ngoài không khí là:
 Xem đáp án
Xem đáp án
Đáp án A
Khí không màu hóa nâu ngoài không khí là: NO.
2NO(không màu)+ O2→ 2NO2 (nâuđỏ)
Câu 21:
Dung dịch muối NH4Cl có môi trường?
 Xem đáp án
Xem đáp án
Đáp án B
Dung dịch muối NH4Cl có môi trường: Axit.
NH4Cl → NH4++ Cl-
NH4++ H2O → NH3+ H3O+
Câu 22:
Hợp chất nào sau đây của nitơ không được tạo ra khi cho HNO3tác dụng với kim loại?
 Xem đáp án
Xem đáp án
Đáp án D
N2O5 là oxit cao nhất của nitơ. Trong N2O5thì N số oxi hóa +5 nên không thể tạo ra khi cho kim loại tác dụng với HNO3.
Câu 23:
Các kim loại đều tác dụng được với dung dịch HCl nhưng không tác dụng với dung dịch HNO3đặc, nguội:
 Xem đáp án
Xem đáp án
Đáp án A
Các kim loại đều tác dụng được với dung dịch HCl nhưng không tác dụng với dung dịch HNO3đặc, nguội: Fe, Al, Cr
Phương trình phản ứng:
Fe + 2HCl → FeCl2+ H2
2Al + 6HCl → 2AlCl3+ 3H2
Cr + 2HCl → CrCl2+ H2
Câu 24:
Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là chất khử?
 Xem đáp án
Xem đáp án
Đáp án C
Phản ứng NH3 đóng vai trò là chất khử là: 8NH3+ 3Cl2→ 6NH4Cl + N2
Vì số oxi hóa của N tăng từ -3 lên 0 sau phản ứng.
Câu 25:
Hãy cho biết phản ứng nào sau đây không có trong quá trình sản xuất HNO3trong công nghiệp?
 Xem đáp án
Xem đáp án
Đáp án D
Quá trình sản xuất HNO3:
NH3→ NO → NO2→ HNO3
Câu 26:
Thuốc nổ đen là hỗn hợp nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Thành phần của thuốc nổ đen KNO3(74,64%), C (13,51%), S (11,85%)
2KNO3+ 3C + S → K2S + N2+ 3CO2
Câu 27:
Hợp chất nào sau đây nitơ có số oxi hóa cao nhất?
 Xem đáp án
Xem đáp án
Đáp án A
Trong hợp chất N2O5 thì N có số oxi hóa cao nhất (+5).
Câu 28:
Cho phản ứng: FeO + HNO3→ Fe(NO3)3+ NO + H2O. Hệ số của HNO3trong phản ứng trên là:
 Xem đáp án
Xem đáp án
Đáp án B
3FeO + 10HNO3→ 3Fe(NO3)3+ NO + 5H2O
Câu 29:
Viết phương trình điện li và phân loại các chất sau: NaOH, HClO, Na2SO4, Zn(OH)2.
 Xem đáp án
Xem đáp án
Phương trình điện li và phân loại:
- Bazơ: NaOH → Na+ +OH-
- Axit: HClO ⇄ H+ + ClO-
- Muối: Na2SO4 → 2Na+ + SO42-
- Hiđroxit lưỡng tính: Zn(OH)2:
+ Sự phân li theo kiểu bazơ: Zn(OH)2 ⇄ Zn2+ + 2OH-
+ Sự phân li theo kiểu axit: Zn(OH)2 ⇄ 2H+ + ZnO2
Câu 30:
Dung dịch B chứa 0,2 mol Na+, 0,2 mol Cl-, x mol K+và y mol CO32-. Cô cạn B thì thu được 25,5 gam muối khan. Tìm giá trị của x và y? (1 điểm)
 Xem đáp án
Xem đáp án
Áp dụng định luật bảo toàn điện tích ta có: 0,2 + x = 0,2 + 2y suy ra x – 2y = 0 (1)
Có mmuối= 0,2.23 + 0,2. 35,5 + 39x + 60y = 25,5
Suy ra 39x + 60y = 13,8 (2)
Từ (1) và (2) suy ra x = 0,2 và y = 0,1
Câu 31:
Hoà tan hoàn toàn m gam nhôm trong dung dịch HNO3dư ta thu được 3,36 lít khí N2O là sản phẩm khử duy nhất ở (đktc). Tìm giá trị của m cần dùng. (1 điểm)
 Xem đáp án
Xem đáp án
Số mol của N2O là: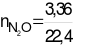 = 0,15 mol
= 0,15 mol
Phương trình phản ứng:

Suy ra m = mAl= 0,4.27 = 10,8 gam.
( Cho Al=27; Na=23;K=39; Cl=35,5; C=12;O=16; N=14)
