Đề kiểm tra Hóa 11 giữa học kì 1 có đáp án (Mới nhất) (đề 1)
-
2862 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
Câu 2:
Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10 nên cấu hình electron của X là 1s22s22p63s23p4 → X có 6 electron lớp ngoài cùng → X là phi kim.
Câu 3:
Hợp chất nào sau đây ở dạng tinh thể, dễ tan trong nước và có nhiệt độ nóng chảy cao?
 Xem đáp án
Xem đáp án
Chọn đáp án A
NaCl chứa liên kết ion nên dễ tan trong nước và có nhiệt độ nóng chảy cao.
Câu 4:
Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa - khử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phản ứng 2Na + 2H2O → 2NaOH + H2 là phản ứng oxi hóa – khử, do có sự thay đổi số oxi hóa của một số nguyên tố sau phản ứng.
Câu 5:
Cho phương trình phản ứng a Al + b HNO3 → c Al(NO3)3 + d N2O + e H2O. Tỉ lệ (a : e) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
Vậy a : e = 8 : 15.
Câu 6:
Nitơ trong hợp chất nào sau đây vừa có tính oxi hoá vừa có tính khử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nitơ trong NaNO2 có số oxi hóa +3; đây là số oxi hóa trung gian của nitơ. Do đó nitơ trong NaNO2 vừa có tính oxi hóa, vừa có tính khử
Câu 7:
Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu đỏ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dung dịch HCl là dung dịch axit, làm quỳ tím chuyển sang màu đỏ.
HCl → H+ + Cl-
Câu 8:
Ozon là một dạng thù hình quan trọng của oxi. Trong tự nhiên có 1 lớp ozon mỏng hình thành ở tầng bình lưu, cách mặt đất khoảng 15-35 km – tùy địa điểm, nó có tác dụng ngăn các bức xạ nguy hại như tia cực tím, tia vũ trụ, bảo vệ các sinh vật trên Trái Đất. Hình ảnh bên dưới mô phỏng cho lỗ hổng tầng ozon. Em hãy cho biết công thức phân tử của ozon là

 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Công thức phân tử của ozon là O3
Câu 9:
Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có khí nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khí thải trong nhà máy có khí H2S
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Câu 10:
Thực hiện thí nghiệm như hình vẽ mô phỏng dưới đây. Em hãy cho biết, chất lỏng trong bình (c) có thể là chất nào sau đây?
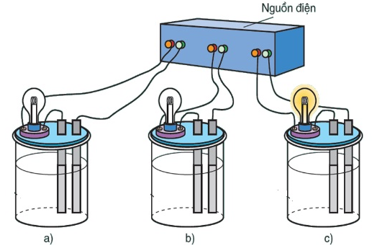
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Chất lỏng trong bình (c) dẫn điện được, do đó có thể là dung dịch muối ăn.
Câu 11:
Chất nào sau đây thuộc loại chất điện li yếu?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
HF là axit yếu, là chất điện li yếu.
Câu 12:
Chất nào dưới đây có tính lưỡng tính?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Al(OH)3 có tính lưỡng tính.
Phân li theo kiểu axit:
Al(OH)3 → H+ + AlO2- + H2O
Phân li theo kiểu bazơ:
Al(OH)3 → Al3+ + 3OH-.
Câu 13:
Chất nào sau đây là muối axit?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Muối axit là muối mà gốc axit vẫn còn hiđro có thể phân li ra H+.
NaHSO4 là muối axit.
NaHSO4 → Na+ + HSO4-
HSO4- → H+ + SO42-
(Coi HSO4- phân li hoàn toàn).
Câu 14:
Dung dịch chất nào sau đây (có cùng nồng độ) dẫn điện tốt nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Với các dung dịch có cùng nồng độ, dung dịch nào có nồng độ ion trong dung dịch lớn nhất thì dẫn điện tốt nhất.
K2SO4 có độ dẫn điện tốt nhất.
Câu 15:
Sau khi nhúng lần lượt từng giấy chỉ thị pH (có sự chuyển màu tương tự như quỳ tím) vào 4 cốc, mỗi cốc chứa 1 chất lỏng được đánh số như trên giấy chỉ thị. Khẳng định nào sau đây là đúng?

 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cốc 1 chứa dung dịch NaOH.
Loại B vì nước cất không làm đổi màu chất chỉ thị.
Loại C và D vì các dung dịch axit làm giấy quỳ tím chuyển sang màu đỏ.
Câu 16:
Phản ứng nào sau đây có phương trình ion rút gọn là H+ + OH- → H2O?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phương trình KOH + HCl → KCl + H2O có phương trình ion thu gọn là:
H+ + OH- → H2O
Câu 17:
Dãy gồm các ion cùng tồn tại trong một dung dịch là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các ion cùng tồn tại trong một dung dịch là: K+, Ba2+, OH–, Cl–.
Câu 18:
Cho các dung dịch riêng biệt: HCl, Ba(OH)2, KHSO4, H2SO4, KOH. Số chất tác dụng với dung dịch Ba(HCO3)2 tạo kết tủa là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các chất thỏa mãn đề bài là: Ba(OH)2, KHSO4, H2SO4, KOH.
Câu 19:
Cho các dung dịch có cùng nồng độ: K2CO3 (1), H2SO4 (2), HCl (3), KNO3 (4). Giá trị pH của các dung dịch được sắp xếp theo chiều tăng từ trái sang phải là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Dung dịch có tính bazơ càng mạnh, pH càng lớn.
Thứ tự tăng dần giá trị pH là: H2SO4, HCl, KNO3, K2CO3.
Câu 20:
Hình ảnh bên dưới là sản phẩm một loại phân bón trên thị trường. Em hãy cho biết, nó được xếp vào loại nào sau đây

 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phân NPK là phân tổng hợp.
Câu 21:
Loại phân bón hoá học mà độ dinh dưỡng được tính bằng thành phần % theo khối lượng của P2O5 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phân lân có độ dinh dưỡng được tính bằng thành phần % theo khối lượng của P2O5.
Câu 22:
Chất thường được dùng làm bột nở là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
NH4HCO3 thường dùng làm bột nở.
Câu 23:
Kim loại bị thụ động trong HNO3 đặc, nguội là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Al, Fe, Cr bị thụ động hóa trong HNO3 đặc, nguội.
Câu 24:
Chất nào sau đây vừa phản ứng được với axit, vừa có thể phản ứng với bazơ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
NaHCO3 có tính lưỡng tính, vừa phản ứng với axit, vừa phản ứng với bazơ. Ví dụ:
NaHCO3 + HCl → NaCl + CO2 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
Câu 25:
Trong phản ứng nào sau đây, nitơ thể hiện tính khử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong phản ứng N2 + O2 → 2NO, nitơ thể hiện tính khử. Do số oxi hóa của N tăng từ 0 lên +2 sau phản ứng.
Câu 26:
Trong phòng thí nghiệm, người ta thường thu khí bằng một trong ba cách như trong hình vẽ. Hãy cho biết khí nitơ có thể được thu bằng cách nào?
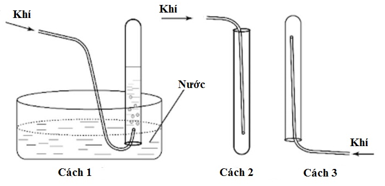
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nitơ có thể thu được bằng cách 1 hoặc cách 3, do N2 không tan trong nước và N2 nhẹ hơn không khí.
Câu 27:
Tính chất hóa học đặc trưng của amoniac là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Tính chất hóa học đặc trưng của amoniac là tính bazơ yếu và tính khử.
Câu 28:
Chất có thể dùng để làm khô khí NH3 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Chất có thể dùng để làm khô khí NH3 là NaOH rắn. Do NaOH rắn có khả năng hút ầm và không tác dụng với NH3.
Câu 29:
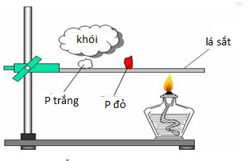
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Thí nghiệm chứng minh photpho trắng kém bền với nhiệt hơn photpho đỏ.
Câu 30:
Trung hòa 100 ml dung dịch HCl 0,5 M cần dùng vừa đủ V ml dung dịch NaOH 1M. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Theo phương trình: nNaOH = nHCl = 0,05 mol
→ V = 0,05 lít = 50 ml
Câu 31:
Cho 35,84 gam kim loại X phản ứng vừa đủ với 21,504 lít khí Cl2 (đktc) tạo ra một muối clorua. Kim loại X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Theo phương trình:
Với n = 3 → MX = 56 (Fe)
Câu 32:
Cho m gam kim loại Cu phản ứng hoàn toàn với dung dịch HNO3 loãng (dư), thu được 3,696 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Bảo toàn e:
→ nCu = 0,2475 mol
→ m = 15,84 gam
Câu 33:
Trộn 500 ml dung dịch chứa hỗn hợp HNO3 0,08M và H2SO4 0,01M với 500 ml dung dịch KOH x M thu được 1 lít dung dịch có pH bằng 12. Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
pH = 12 > 7 → OH- dư, H+ phản ứng hết
→ pOH = 14 – 12 = 2 → [OH-] = 10-2M
Câu 34:
Dung dịch X gồm 0,1 mol NH4+; 0,15 mol Mg2+; 0,1 mol Na+; 0,18 mol Cl− và x mol Y2-. Cô cạn dung dịch X, thu được m gam muối khan. Ion Y2− và giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Loại A và C do CO32- kết hợp với Mg2+ tạo thành kết tủa nên không tồn tại dung dịch.
Bảo toàn điện tích:
→ x = 0,16 mol
Bảo toàn khối lượng:
m = 0,1.18 + 0,15.24 + 0,1.23 + 0,18.35,5 + 0,16.96 = 29,45 gam
Câu 35:
Hòa tan 9,8 gam axit H3PO4 vào 130 ml dung dịch KOH 1M, sau phản ứng hoàn toàn thu được dung dịch chứa
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
thu được hai muối KH2PO4 và K2HPO4
Câu 36:
Cho m gam P2O5 tác dụng với 507 ml dung dịch NaOH 2M, sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cô cạn dung dịch X, thu được 3m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi cho P2O5 vào nước có phản ứng:
P2O5 + 3H2O → 2H3PO4
Do đó để bài toán trở nên đơn giản, ta coi bài toán như phản ứng của H3PO4 với dung dịch kiềm:
Các trường hợp có thể xảy ra:
+ TH1: NaOH và H3PO4 phản ứng vừa đủ tạo muối
Khi đó
Áp dụng định luật bảo toàn khối lượng ta có:
NaOH dư
Do đó trường hợp này không thỏa mãn
+ TH2: Chất rắn thu được gồm Na3PO4 và NaOH dư
Có phản ứng xảy ra như sau:
H3PO4 + 3NaOH → Na3PO4 + 3H2O
Do đó:
Câu 37:
Hoà tan hoàn toàn 16,1 gam hỗn hợp gồm Na, K và Ca vào nước, thu được dung dịch X và 6,72 lít khí H2 (đktc). Dung dịch Y gồm HNO3 và H2SO4, tỉ lệ mol tương ứng là 2: 5. Trung hoà dung dịch X bởi dung dịch Y, tổng khối lượng các muối được tạo ra là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Gọi số mol HNO3 là 2x mol và H2SO4 là 5x mol
→ 2x + 2.5x = 0,6 → 0,05 mol
→ mmuối = 16,1 + 2.0,05.62 + 5.0,05.96 = 46,3 gam
Câu 38:
Nung hỗn hợp X gồm Cu(NO3)2, KNO3 và NaNO3 ở nhiệt độ cao đến phản ứng hoàn toàn thu được 13,44 lít hỗn hợp khí Y (ở đktc). Hấp thụ khí Y vào nước thu được 40 lít dung dịch Z và còn lại 2,24 lít khí thoát ra (ở đktc). Giá trị pH của dung dịch Z là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khí Y gồm NO2 (a mol) và O2 (b mol)
→ nY = a + b = 0,6
→ a = 0,4 và b = 0,2
→ [H+] = 0,01
→ pH = 2
Câu 39:
Cho hỗn hợp gồm 0,56 gam Fe và 0,96 gam Cu vào 200 ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và KNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Ta có: nFe = 0,01 mol; nCu = 0,015 mol;
(1)
(2)
Tổng số mol H+ tham gia phản ứng (1) và (2) là 0,08 mol
→ H+ dư 0,2 – 0,08 = 0,12 mol
Dung dịch X có chứa Cu2+ (0,015 mol), Fe3+ (0,01 mol) và H+ (0,12 mol)
H+ + OH- → H2O
Cu2+ + 2OH- → Cu(OH)2
Fe3+ + 3OH- → Fe(OH)3
→ V = 0,18 lít = 180 ml
Câu 40:
Hấp thụ hết 5,6 lít khí SO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2SO3, thu được 250 ml dung dịch X. Cho từ từ đến hết 125 ml X vào 375 ml dung dịch HCl 0,5M, thu được 3,36 lít khí (đktc). Mặt khác, cho 125 ml X tác dụng với dung dịch Ba(OH)2 dư, thu được 54,25 gam kết tủa. Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Xét thí nghiệm 1, đặt số mol phản ứng là a mol; phản ứng là b mol
Xét thí nghiệm 2, nS(X) = n↓ = 0,25 mol
→ 250 ml dung dịch X chứa 0,5 mol S
Bảo toàn nguyên tố S: y = 0,5 – 0,25 = 0,25 mol
Chia 0,5 mol S thành 0,125 mol và 0,375 mol
Bảo toàn điện tích:
Bảo toàn nguyên tố K: x = 0,625 – 0,25.2 = 0,125
