Đề kiểm tra Hóa 11 giữa học kì 1 có đáp án (Mới nhất) (đề 8)
-
2859 lượt thi
-
26 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Chất điện li yếu gồm: axit trung bình và yếu, bazơ không tan, H2O, một số muối.
⇒ Chất điện li yếu là: H2SO3.Câu 2:
N2 thể hiện tính khử trong phản ứng với
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
N2 thể hiện tính khử trong phản ứng với O2
N2 + O2 → 2NO (đk: tia lửa điện)
Trong phản ứng này, số oxi hóa của N tăng từ 0 lên +2. Do đó, N2 thể hiện tính khử.
Câu 3:
Chất nào sau đây là axit theo Areniut?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Theo Areniut axit là chất khi tan trong nước phân li cho ion H+.
Vậy HCl là axit theo Areniut:
HCl → H+ + Cl-
Câu 4:
Chất nào dưới đây vừa tác dụng với dung dịch HCl, vừa tác dụng với NaOH?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
NaHCO3 + HCl → NaCl + CO2 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
Câu 5:
HNO3 không thể hiện tính oxi hóa mạnh khi phản ứng với chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Axit HNO3 không thể hiện tính oxi hóa khi tác dụng với Fe2O3 vì không có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng.
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Câu 6:
Nhúng quỳ tím vào dung dịch chứa chất nào sau đây, quỳ chuyển sang màu đỏ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dung dịch có môi trường axit làm quỳ tím chuyển đỏ.
Dung dịch HCl là dung dịch axit, làm quỳ tìm chuyển sang màu đỏ.Câu 7:
Ở cùng điều kiện về nhiệt độ, áp suất và nồng độ, dung dịch nào sau đây dẫn điện tốt nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
CH3COOH, H2S là chất điện li yếu nên dẫn điện kém.
So sánh HCl và H2SO4 (2 chất điện li mạnh) thấy H2SO4 phân li ra nhiều ion hơn.
Vậy ở cùng điều kiện về nhiệt độ, áp suất và nồng độ, dung dịch dẫn điện tốt nhất là: H2SO4
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Kim loại không phản ứng trong dung dịch HNO3 đặc, nguội là Al.Câu 9:
Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
NH4HCO3 NH3 + CO2 + H2O
Khi sử dụng bột nở này, khí NH3 và CO2 thoát ra làm cho bánh căng phồng và xốp.
Câu 10:
Phản ứng chỉ có phương trình ion rút gọn: 2H+ + S2- → H2S là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Na2S + 2HCl → H2S + 2NaCl
Có phương trình ion rút gọn: 2H+ + S2- → H2S
Câu 11:
Nguyên tố nitơ có số oxi hóa trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tố nitơ có số oxi hóa trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O lần lượt là: +2, +4, -3, -3, +1
Câu 12:
Dãy các muối amoni khi bị nhiệt phân đều tạo khí NH3 là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
(NH4)2CO3 2NH3 + CO2 + H2O
NH4HCO3 NH3 + CO2+ H2O
NH4Cl NH3 + HCl
Chú ý:
NH4NO3 N2O + 2H2O
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dãy gồm các ion không cùng tồn tại trong một dung dịch là: NH4+, OH-, Fe3+, Cl-
Do Fe3+ + 3OH- → Fe(OH)3
Câu 14:
Dung dịch A có a mol NH4+, b mol Mg2+, c mol SO42-, d mol HCO3-. Biểu thức nào biểu thị sự liên quan giữa a, b, c, d?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Theo định luật bảo toàn điện tích, trong một dung dịch có: điện tích cation = điện tích anion
Suy ra a + 2b = 2c + d.
Câu 15:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A sai vì N2 không độc.
C sai vì khi tác dụng với kim loại hoạt động nitơ thể hiện tính oxi hóa.
D sai vì số oxi hóa cao nhất của nitơ trong hợp chất là +5.
Câu 16:
Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein. Hiện tượng xảy ra trong thí nghiệm là
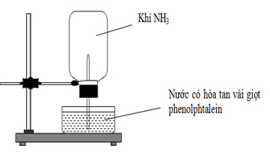
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Do NH3 tan tốt trong nước nên thể tích NH3 trong bình giảm → nước phun vào bình.
- Khi NH3 tan trong nước thì tạo thành dung dịch bazơ yếu nên làm nước hòa tan sẵn phenolphthalein chuyển màu hồng
→ Hiện tượng: Nước phun vào bình và chuyển thành màu hồng.
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
mol, mol
Phương trình phản ứng:
N2 + 3H2 ⇄ 2NH3
Xét tỉ lệ: suy ra N2 phản ứng hết, H2 dư
Suy ra (phản ứng) = 0,1.20% = 0,02 mol
Theo phương trình phản ứng = 0,04 mol
Thể tích khí NH3 thu được sau phản ứng (đktc) là: 0,04.22,4 = 0,896 lítCâu 18:
Cho dung dịch KOH đến dự vào 50 ml (NH4)2SO4 1M, đun nóng nhẹ. Sau phản ứng thu được thể tích khí thoát ra (đktc) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
= 0,05 mol
Phương trình phản ứng :
Theo phương trình phản ứng: = 0,1 mol
Vậy V = 0,1.22,4 = 2,24 lit
Câu 19:
Trộn 70ml dung dịch HCl 0,12M với 30ml dung dịch Ba(OH)2 0,10M thu được dung dịch A. pH của dung dịch A là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Ta có: = nHCl = 0,12.0,07 = 0,0084 mol
= 2.0,03.0,1=0,006 mol
Phương trình: H+ + OH- → H2O
Nhận thấy nên H+ dư
Suy ra (dư) = 0,0084 − 0,006 = 0,0024 mol
[H+ dư] = = 0,024M
Suy ra pH = −lg[H+] = −log(0,024) = 1,62
Câu 20:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
A đúng vì pH tăng thì nồng độ OH- trong dung dịch tăng nên độ axit giảm
C. pH < 7 là môi trường axit làm quỳ hóa đỏ
D. pH > 7 là môi trường bazơ làm quỳ hóa xanh
Câu 21:
Cho các phát biểu sau:
(1) NH3 là chất khí có mùi khai và tan nhiều trong nước.
(2) Tất cả các muối amoni đều tan trong nước và bền nhiệt.
(3) Trong công nghiệp, N2 được điều chế bằng phương pháp chưng cất phân đoạn không khi lỏng.
(4) Dung dịch HNO3 đặc phản ứng với tất cả các kim loại.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phát biểu đúng: (1), (3)
Phát biểu (2) sai vì các muối amoni kém bền với nhiệt.
Phát biểu (4) sai vì HNO3 không phản ứng được với vàng và Pt.
Câu 22:
Hòa tan hết hỗn hợp 3 kim loại Al, Zn, Mg trong dung dịch HNO3 loãng vừa đủ, thu được dung dịch X và không thấy khí thoát ra. Cô cạn dung dịch X, thu được m gam muối khan (trong đó O chiếm 61,364% về khối lượng). Nung m gam muối khan nói trên với khối lượng không đối, thu được 19,2 gam chất rắn. Giá trị của m gần nhất giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Do sau khi hòa tan kim loại bằng HNO3 không có khí thoát ra nên sản phẩm khử là NH4NO3.
Muối có Mg(NO3)2, Al(NO3)3, Zn(NO3)2 và NH4NO3
Suy ra chất rắn nung nóng có MgO, ZnO, Al2O3
Đặt khối lượng kim loại trong 19,2 g rắn trên là x gam và số mol O là y mol
Suy ra x + 16y =19,2 mol
Trong muối nitrat của kim loại trong X có = 2y
Bảo toàn e có = = 0,25y
Trong muối khan của dung dịch X có
%O = = 61,364%
Nên x = 12,8 và y = 0,4
Suy ra m = x + 62.2y + 80.0,25y = 70,4 gam.
Câu 23:
Cho dung dịch các chất: Ca(HCO3)2, NaOH, (NH4)2CO3, KHSO4, BaCl2 . Ở điều kiện thường khi trộn từng cặp 2 chất với nhau. Số cặp chất xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
Ca(HCO3)2 + (NH4)2CO3 → CaCO3↓ + 2NH4HCO3
Ca(HCO3)2 + 2KHSO4 → CaSO4 + K2SO4 + 2CO2↑ + 2H2O
2NaOH + (NH4)2CO3 → Na2CO3 + 2NH3↑ + 2H2O
2NaOH + 2KHSO4 → Na2SO4 + K2SO4 + 2H2O
(NH4)2CO3 + 2KHSO4 → K2SO4 + (NH4)2SO4 + CO2↑ + 2H2O
(NH4)2CO3 + BaCl2 → BaCO3↓ + 2NH4Cl
KHSO4 + BaCl2 → BaSO4↓ + KCl + HCl
Hoặc 2KHSO4 + BaCl2 BaSO4↓ + K2SO4 + 2HCl
Câu 24:
Hòa tan hoàn toàn 3,76 gam hỗn hợp X gồm S, FeS và FeS2 trong dung dịch HNO3, đặc nóng, dư thu được 0,48 mol NO2 (là sản phẩm khử duy nhất) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư, lọc và nung kết tủa đến khối lượng không đổi được m gam hỗn hợp rắn Z. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Coi hỗn hợp X chỉ gồm Fe và S
Gọi nFe = a mol; nS = b mol
Suy ra 56a + 32b = 3,76 (1)
Bảo toàn electron có: ne nhường = ne nhận
Suy ra 3a + 6b = 0,48 (2)
Từ (1) và (2) suy ra: a = 0,03; b = 0,065
Kết tủa thu được gồm Fe(OH)3 và BaSO4
Suy ra Z gồm Fe2O3 và BaSO4
Áp dụng ĐLBT nguyên tố với Fe và S, có:
= nFe = 0,015 mol
= nS = 0,065 mol
Ta có: m = + = 0,015.160 + 0,065.233 = 17,545 gam
Câu 25:
Viết phương trình phân tử và ion rút gọn của các phản ứng sau:
a) AgNO3 + NaCl
b) K2CO3 + HCldư
c) NaOH + H2SO4 loãng
d) Ba(OH)2 + NaHCO3 (tỉ lệ mol 1:2)
 Xem đáp án
Xem đáp án
a) AgNO3 + NaCl → AgCl↓ + NaNO3
Phương trình ion: Ag+ + Cl- → AgCl↓
b) K2CO3 + 2HCldư → 2KCl + CO2↑ + H2O
Phương trình ion: CO32- + 2H+ → CO2↑ + H2O
c) 2NaOH + H2SO4 loãng → Na2SO4 + 2H2O
Phương trình ion: OH- + H+ → H2O
d) Ba(OH)2 + 2NaHCO3 → BaCO3↓ + Na2CO3 + 2H2O
Phương trình ion:
Ba2+ + 2HCO3- + 2OH- → BaCO3↓+ CO32- + 2H2O
Câu 26:
Cho 12,45 gam hỗn hợp Al, Fe tác dụng hết với dung dịch HNO3 1M (lấy dư 25% so với lượng phản ứng), thu được dung dịch A và 6,72 lít (đktc) khí NO là sản phẩm khử duy nhất
a) Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp ban đầu
b) Tính CM các chất có trong dung dịch A. (Coi thể tích dung dịch thay đổi không đáng kể).
 Xem đáp án
Xem đáp án
a) Gọi số mol Al, Fe lần lượt là a, b (mol)
Suy ra 27a + 56b = 12,45 (1)
Phương trình phản ứng:
Suy ra a + b = mol (2)
Từ (1) và (2) suy ra a = 0,15, y = 0,15
Vậy %mAl = = 32,53%
%mFe = 100% - 32,53% = 67,47%
b) Dung dịch A gồm Al(NO3)3, Fe(NO3)3, HNO3 dư
Do HNO3 lấy dư 25% so với lượng phản ứng nên (dư) = 0,3 mol,
(phản ứng) = 0,9 mol,
Ta có: V = = = 0,9 lit
= 0,15 mol suy ra = M
= 0,15 mol suy ra = M
(dư) = 0,3 mol suy ra (dư) = M.
