Đề thi Hóa học 11 Học kì 2 có đáp án (Đề 10)
-
3667 lượt thi
-
4 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
1. Phenol được phát hiện vào năm 1834, khi nó được chiết xuất từ nhựa than đá. Phần lớn phenol được dùng để sản xuất poli(phenolfomanđehit) (dùng làm chất dẻo, chất kết dính).
Anđehit axetic là chất khí không màu, mùi xốc, tan rất tốt trong nước và các dung môi hữu cơ, chủ yếu được dùng để sản xuất axit axetic.
Từ axetilen, hãy viết phương trình phản ứng điều chế phenol và anđehit axetic theo sơ đồ sau, ghi rõ điều kiện (nếu có):
benzen clobenzen natri phenolat phenol
axetilen etilen anđehit axetic.
2. Phân biệt: anđehit axetic (CH3CHO), axit axetic (CH3COOH), phenol (C6H5OH), etanol (C2H5OH), hexan (C6H14).
 Xem đáp án
Xem đáp án
1.
Axetilen: CHCH; Anđehit axetic: CH3CHO.
Sơ đồ phản ứng:
C6H6C6H5Cl C6H5ONaC6H5OH
C2H2C2H4CH3CHO.
(1) 3CHCH C6H6
(2) C6H6+ Cl2C6H5Cl + HCl
(3) C6H5Cl + NaOH C6H5ONa + NaCl
(4) C6H5ONa + CO2+ H2O C6H5OH + NaHCO3
(5) CHCH + H2CH2=CH2
(6) 2CH2=CH2+ O22CH3CHO
2.
- Trích mẫu thử.
- Dùng quỳ tím cho vào từng mẫu thử:
+ Dung dịch làm quỳ tím hóa đỏ là CH3COOH.
+ Không làm đổi màu quỳ tím: CH3CHO, C6H5OH, C2H5OH, C6H14(nhóm I)
- Dùng dung dịch Br2cho vào từng mẫu thử ở nhóm I.
+ Thấy tạo thành kết tủa trắng là C6H5OH.
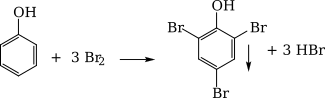
+ Chỉ thấy dung dịch Br2nhạt màu là CH3CHO.
CH3CHO + Br2+ H2O CH3COOH + 2HBr
+ Không có hiện tượng gì: C2H5OH, C6H14.
Dùng kim loại Na:
+ Thấy có khí thoát ra là C2H5OH.
C2H5OH + Na C2H5ONa + \(\frac{1}{2}\) H2
+ Không có hiện tượng gì là C6H14.
Câu 2:
1. Viết phương trình phản ứng chứng minh (mỗi tính chất viết 1 phương trình phản ứng):
2. Từ khoai (có thành phần chủ yếu là tinh bột) và các hóa chất, thiết bị có đủ, hãy viết phương trình phản ứng điều chế etyl clorua, đietyl ete và polietilen.
3. Cho các chất sau: phenol, metanol, etyl clorua lần lượt tác dụng với CuO, dung dịch HCl, dung dịch KOH loãng. Hãy viết các phương trình phản ứng xảy ra (nếu có).
 Xem đáp án
Xem đáp án
1.
a. Anđehit axetic có tính khử.
CH3CHO + 2AgNO3+ 3NH3+ H2O CH3COONH4+ 2Ag + 2NH4NO3
b. Benzen thể hiện tính chất của hiđrocacbon no.
C6H6+ Br2C6H5Br + HBr (phản ứng thế)
c. Stiren tham gia phản ứng trùng hợp.
nC6H5CH=CH2(-CH(C6H5)-CH2-)n
d. Trong phân tử phenol, ảnh hưởng của gốc phenyl đến nhóm -OH.
C6H5OH + NaOH C6H5ONa + H2O
2.
Tinh bột: (C6H10O5)n.
(C6H10O5)n+ nH2O nC6H12O6(glucozơ)
C6H12O62C2H5OH + 2CO2
Điều chế etyl clorua (C2H5Cl):
C2H5OH + HCl C2H5Cl + H2O
Điều chế đietyl ete ((C2H5)2O):
2C2H5OH (C2H5)2O + H2O
Điều chế polietilen (-CH2-CH2-)n:
nCH2=CH2(-CH2-CH2-)n
3.
Phenol: C6H5OH; metanol: CH3OH; etyl clorua: C2H5Cl.
Phương trình hóa học:
C6H5OH + KOH C6H5OK + H2O
CH3OH + CuO HCHO + Cu + H2O
CH3OH + HCl CH3Cl + H2O
C2H5Cl + KOH C2H5OH + KCl
Câu 3:
Chia m gam hỗn hợp X gồm ancol propylic và phenol thành 2 phần bằng nhau:
- Phần 1: tác dụng vừa đủ với 300 ml dung dịch Br20,5M thu được a gam kết tủa trắng.
- Phần 2: tác dụng với Na dư thu được 1,68 lít khí H2(đktc).
Tính m và a.
 Xem đáp án
Xem đáp án
X gồm: ancol propylic (CH3CH2CH2OH) và phenol (C6H5OH).
Phần I: \({n_{B{r_2}}}\)= 0,15 (mol).
Phương trình hóa học:

nphenol= n=\(\frac{{{n_{B{r_2}}}}}{3}\) = 0,05 (mol).
a = m= 0,05×331 = 16,55 (gam).
Phần II: \({n_{{H_2}}}\)= 0,075 (mol).
Phương trình hóa học;
CH3CH2CH2OH + Na CH3CH2CH2ONa + \(\frac{1}{2}\)H2
C6H5OH + Na C6H5ONa + \(\frac{1}{2}\)H2
\({n_{{C_3}{H_7}OH}} + {n_{{C_6}{H_5}OH}} = 2{n_{{H_2}}} = 0,15\)(mol)
\({n_{{C_3}{H_7}OH}}\) = 0,15 – 0,05 = 0,1 (mol)
m = mX= \({m_{{C_3}{H_7}OH}} + {m_{{C_6}{H_5}OH}}\)= 2×(0,1×60 + 0,05×94) = 21,4 (gam).
Câu 4:
Cho hỗn hợp X gồm glixerol và một ankanol A.
- Đốt cháy hoàn toàn a gam hỗn hợp X cần vừa đủ 21,84 lít khí O2(đktc), thu được 18 gam H2O.
- Mặt khác với a/3 gam hỗn hợp X có thể hòa tan tối đa 2,45 gam Cu(OH)2.
a. Tính a và xác định công thức phân tử của ankanol A.
b. Nung nóng b gam ankanol A trên với CuO trong ống kín thu được hỗn hợp hơi Y. Ngưng tụ hỗn hợp Y thành dạng lỏng rồi cho toàn bộ chất lỏng này (gồm anđehit, ancol dư và H2O) tác dụng với Na dư sinh ra 448 ml khí H2 (đktc). Tính b và xác định công thức cấu tạo đúng của ankanol A.
c. Đun nóng hỗn hợp Z gồm 3 gam A và 1,6 gam metanol với H2SO4 đặc ở 140oC. Sau khi phản ứng xảy ra hoàn toàn thu được m gam hỗn hợp 3 ete. Tính m.
 Xem đáp án
Xem đáp án
X gồm glixerol (C3H5(OH)3) và một ankanol A (CnH2n+2O).
a. Sơ đồ phản ứng: X + O2CO2+ H2O.
\({n_{{O_2}}}\)= 0,975 (mol); \({n_{{H_2}O}}\)= 1 (mol).
\({n_{Cu{{(OH)}_2}}}\)= 0,025 (mol).
\({n_{{C_3}{H_5}{{(OH)}_3}}} = 2{n_{Cu{{(OH)}_2}}}\)= 2×0,025×3 = 0,15 (mol) (do chỉ tác dụng 1/3 hỗn hợp X).
Gọi số mol của ankanol A là x (mol) và số mol CO2sinh ra khi đốt cháy X là y (mol).
Ta có: nX= \({n_{{H_2}O}} - {n_{C{O_2}}}\)
0,15 + x = 1 – y x + y = 0,85 (*).
Bảo toàn nguyên tố O: nO(X)+ 2\({n_{{O_2}}}\)= 2\({n_{C{O_2}}}\)+ \({n_{{H_2}O}}\).
3×0,15 + x + 2×0,975 = 2y + 1
x – 2y = -1,4 (**).
Từ (*) và (**), suy ra: x = 0,1; y = 0,75.
Ta có: \({n_{C{O_2}}}\)= 3×0,15 + 0,1×n = 0,75 n = 3
Ankanol A là C3H8O.
a = mX= 0,15×92 + 0,1×60 = 19,8 (gam).
b. A Y (anđehit + H2O + Ancol dư).
A là ancol bậc I: CH3CH2CH2OH.
CH3CH2CH2OH + CuO CH3CHO + H2O + Cu
nancol(pư)= \({n_{{H_2}O}}\).
nA= nancol(pư) + nancol(dư) = 2\({n_{{H_2}}}\)= \(\frac{{0,448}}{{22,4}}\) = 0,02 (mol).
b = mA= 0,02×60 = 1,2 (gam).
c. \({n_{{C_3}{H_7}OH}} = \frac{3}{{60}} = 0,05\)(mol); \({n_{C{H_3}OH}} = \frac{{1,6}}{{32}} = 0,05\) (mol)
\(\sum {{n_{ancol}}} \)= 0,05 + 0,05 = 0,1 (mol).
Sơ đồ phản ứng: 2ancol Ete + H2O.
\({n_{{H_2}O}} = \frac{{{n_{ancol}}}}{2} = 0,05\)(mol).
Bảo toàn khối lượng:
mancol= mete+ \({m_{{H_2}O}}\)
3 + 1,6 = m+ 0,05×18 m= 3,7 (gam).
