Bài 40: Ancol - SBT Hóa học 11
-
1447 lượt thi
-
18 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 8:
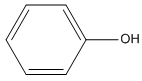
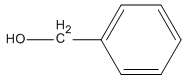
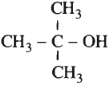
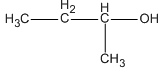
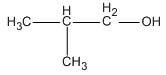
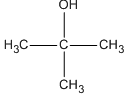
Trong các ancol dưới đây, chất nào không bị oxi hóa bởi CuO (mà không bị gãy mạch cacbon)?
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 9:
Trong số các phản ứng hoá học dưới đây, phản ứng nào là phản ứng oxi hoá - khử ?
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 10:
Viết phương trình hoá học của phản ứng thực hiện các biến hoá dưới đây, ghi rõ điều kiện của từng phản ứng.
Tinh bột (1)→ Glucozơ (2)→ Ancol etylic (3)→ Anđehit axetic
 Xem đáp án
Xem đáp án
(1) (C6H10O5)n + nH2O Enzim→ nC6H12O6
(2) C6H12O6 Enzim→ 2C2H5OH + 2CO2
(3) C2H5OH + CuO to→ C2H5OH + CuO
Câu 11:
Từ ancol propylic và các chất vô cơ, có thể điều chế propen, propyl bromua, đipropyl ete. Viết phương trình hoá học của các phản ứng thực hiện các chuyển hoá đó.
 Xem đáp án
Xem đáp án
CH3−CH2−CH2−OH CH3−CH=CH2 + H2O
CH3−CH2−CH2−OH + HBr CH3−CH2−CH2−Br + H2O
2CH3−CH2−CH2−OHCH3−CH2−CH2−O−CH2−CH2−CH3 + H2O
Câu 12:
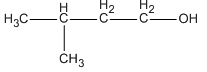
Chất A là một ancol no mạch hở. Để đốt cháy hoàn toàn 0,35 mol A phải dùng vừa hết 31,36 lít O2 (đktc). Hãy xác định công thức phân tử, công thức cấu tạo và tên của A.
 Xem đáp án
Xem đáp án
Ancol no mạch hở là CnH2n+2−x(OH)x; CTPT là CnH2n+2Ox.
Theo phương trình:
1 mol ancol tác dụng với mol O2
0,35 mol ancol tác dụng với
⇒ 3n + 1 - x = 8 ⇒ x = 3n - 7
Ở các ancol đa chức, mỗi nguyên tử cacbon không thể kết hợp với quá 1 nhóm OH ; vì vậy 1 ≤ x ≤ n.
1 ≤ 3n - 7 ≤ n
2,67 ≤ n ≤ 3,5 ; n nguyên ⇒ n = 3
⇒ x = 3.3 - 7 = 2.
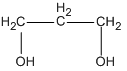
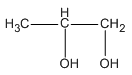
Công thức phân tử: C3H8O2.
Các công thức cấu tạo :
Câu 13:
Chất X là một ancol không no đơn chức, phân tử có 1 liên kết đôi. Để đốt cháy hoàn toàn 1,45 g X cần dùng vừa hết 2,24 lít O2 (đktc).
Xác định công thức phân tử, viết công thức cấu tạo và tên chất X.
 Xem đáp án
Xem đáp án
Chất X có dạng CnH2n-1OH,
CTPT là CnH2nO
Theo phưomg trình:
Cứ (14n + 16) g X tác dụng với mol O2
Theo đầu bài: Cứ 1,45 g X tác dung với (mol) O2.
CTPT: C3H6O.
CTCT: CH2 = CH - CH2 - OH ( propenol )
Câu 14:
Hỗn hợp M chứa hai ancol no, đơn chức, mạch hở kế tiếp nhau trong dãy đồng đẳng. Để đốt cháy hoàn toàn 35,6 g hỗn hợp M cần dùng vừa hết 63,84 lít O2 (đktc).
Hãy xác định công thức phân tử và phần trăm về khối lượng của từng chất trong hỗn hợp M.
 Xem đáp án
Xem đáp án
Đặt công thức của 2 ancol là Cn−H2n−+1OH
Theo phương trình:
(14n− + 18) g ancol tác dụng với mol O2
Theo đầu bài: 35,6 g ancol tác dụng với 2,850 mol O22
⇒ Hai ancol là C3H7OH (x mol) và C4H9OH (y mol)
Từ đó tính được phần trăm khối lượng từng chất (như ở trên).
Câu 15:
Hỗn hợp A chứa 2 ancol no, đơn chức, mạch hở. Để đốt cháy hoàn toàn hỗn hợp A cần dùng vừa hết 3,36 lít O2 (đktc). Trong sản phẩm cháy, khối lượng CO2 nhiều hơn khối lượng H2O là 1,88 g.
1. Xác định khối lượng hỗn hợp A.
2. Xác định công thức phân tử và phần trăm khối lượng của từng chất trong A nếu biết thêm rằng hai ancol đó khác nhau 2 nguyên tử cacbon.
 Xem đáp án
Xem đáp án
1. Công thức chung của hai ancol là Cn−H2n−+1OH và tổng số mol của chúng là a. Khối lượng hỗn hợp: (14n− + 18)a.
Khối lượng hỗn hợp: (14.2,5 + 18).0,04 = 2,12 (g)
2. n < 2,5 < n + 2 ⇒ 0,5 < n < 2,50
Phần cuối giống như ở cách giải 1.
Câu 16:
Hỗn hợp A chứa glixerol và một ancol đơn chức. Cho 20,3 g A tác dụng với natri (lấy dư) thu được 5,04 lít H2 (đktc). Mặt khác 8,12 g A hoà tan vừa hết 1,96 g Cu(OH)2.
Xác định công thức phân tử, các công thức cấu tạo có thể có, tên và phần trăm về khối lượng của ancol đơn chức trong hỗn hợp A.
 Xem đáp án
Xem đáp án
Khi 8,12 g A tác dụng với Cu(OH)2 chỉ có 1 phản ứng hoá học :
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu (đồng(II) glixerat) + 2H2O
Số mol glixerol trong 8,12 g A = 2.số mol Cu(OH)2
Số mol glixerol trong 20,3 g A là:
Khối lượng glixerol trong 20,3 g A là: 0,1.92 = 9,2 (g).
Khối lượng R-OH trong 20,3 g A là: 20,3 - 9,2 = 11,1 (g).
Khi 20,3 g A tác dụng với Na có 2 phản ứng hoá học
2C3H5(OH)3 + 6Na → 2C3H5(ONa)3 + 3H2↑
0,1 mol 0,15mol
2R-OH + 2Na → 2R-ONa + H2↑
x mol 0,5x mol
Số mol H2 = 0,15 + 0,5x = 0,225(mol) ⇒ x = 0,15
Khối lượng 1 mol R-OH :
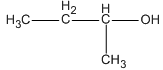
R-OH = 74 ⇒ R = 74 - 17 = 57; R là −C4H9
CTPT: C4H10O
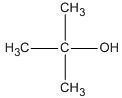
Các CTCT và tên :
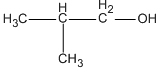
CH3−CH2−CH2−CH2−OH ( butan-1-ol )
Câu 17:
Đun một hỗn hợp 2 ancol no, đơn chức, mạch hở với H2SO4 ở 140°C, thu được 72 g hỗn hợp 3 ete với số mol bằng nhau. Khối lượng nước tách ra trong quá trình tạo thành các ete đó là 21,6 g.
Xác định công thức cấu tạo của 2 ancol và khối lượng mỗi ancol phản ứng.
 Xem đáp án
Xem đáp án
CnH2n+1OH + HOCnH2n+1 → CnH2n+1−O−CnH2n+1 + H2O
CmH2m+1OH + HOCmH2m+1 → CmH2m+1−O−CmH2m+1 + H2O
CnH2n+1OH + HOCmH2m+1 → CnH2n+1−O−CmH2m+1 + H2O
Số mol 3 ete = số mol H2O
Số mol mỗi ete
Khối lượng 3 ete :
(28n + 18).0,4 + (28m + 18).0,4 + (14n + 14m + 18).0,4 = 72.0 ⇒ n + m = 3.
Vì n và m đều nguyên và dương nên chỉ có thể n = 1 và m = 2 (hoặc ngược lại).
Hai ancol là CH3-OH và CH3-CH2-OH.
Số mol mỗi ancol là 1,2 mol.
Khối lượng CH3-OH là: 1,2.32 = 38,4 (g).
Khối lượng C2H5OH là: 1,2.46 = 55,2 (g).
Câu 18:
Hỗn hợp khí A chứa 2 anken kế tiếp nhau trong dãy đồng đẳng. Tỉ khối của A đối với khí nitơ là 1,35.
1. Xác định công thức phân tử 2 anken.
2. Nếu hiđrat hoá một lượng hỗn hợp A (giả sử hiệu suất là 100%) thì được hỗn hợp ancol B, trong đó tỉ lệ về khối lượng giữa ancol bậc một và ancol bậc hai là 43 : 50.
Hãy cho biết tên và phần trăm về khối lượng của từng ancol trong hỗn hợp B.
 Xem đáp án
Xem đáp án
1. Hỗn hợp khí A chứa CnH2n và Cn+1H2n+2 với phân tử khối trung bình là: 1,35 x 28 = 37,8
⇒ CnH2n < 37,8 < Cn+1H2n+2
⇒ 14n < 37,8 < 14n + 14
1,70 < n < 2,70 ⇒ n = 2.
CTPT của 2 anken là C2H4 và C3H6.
2. Giả sử trong 1 moi hỗn hợp A có x mol C3H6 và (1 - x) mol C2H4 :
42x + 28(1 - x) = 37,8 ⇒ x = 0,7
Như vậy, trong 1 mol hỗn hợp A có 0,7 mol C3H6 và 0,3 mol C2H4.
Giả sử hiđrat hoá hoàn toàn 1 mol A :
CH2 = CH2 + H2O → CH3 - CH2 - OH
0,3 mol 0,3 mol
CH3 - CH = CH2 + H2O → CH3 - CH2 - CH2 - OH
a mol a mol
Tỉ lệ khối lượng giữa ancol bậc I so với ancol bậc II :
Hỗn hợp B gồm 0,3 mol CH3 - CH2 - OH; 0,2 mol CH3 - CH2 - CH2 - OH và 0,5 mol 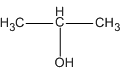
% về khối lượng etanol (ancol etylic) là:
% về khối lượng của propan-l-ol (ancol propylic) là :
Propan-2-ol (ancol isopropylic) chiếm:
Riêng câu 2 cũng có thể lập luận như sau :
Phần trăm khối lượng của ancol bậc II (ancol isopropylic) :
Vậy phần trăm khối lượng của 2 ancol bậc I là 46,2%.
Nếu dùng 1 mol A (37,8 g) thì lượng H2O là 1 mol (18 g) và khối lượng hỗn hợp B là 37,8 + 18, = 55,8 (g), trong đó 0,3 mol C2H4 tạo ra 0,3 mol ancol etylic.
Phần trăm khối lượng của ancol etylic là
và của ancol propylic là: 46,2% - 24,7% = 21,5%.