Đề kiểm tra giữa học kì 2 Hóa 12 có đáp án (Mới nhất) (Đề 19)
-
3681 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Kim loại dẫn điện tốt nhất là bạc (Ag).
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Khi tham gia phản ứng hóa học, kim loại đóng vai trò là chất nhường electron (hay chất khử).
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Ion kim loại có tính oxi hóa mạnh nhất là Fe3+.

Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Ca + H2SO4 → CaSO4 + H2
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Phương pháp điện phân nóng chảy dùng để điều chế các kim loại hoạt động mạnh (từ nhôm trở về trước trong dãy hoạt động hóa học).
Ví dụ: K, Na, Mg, ...
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Phương pháp nhiệt luyện để điều chế kim loại là dùng chất khử mạnh như CO, H2, C, Al để khử ion kim loại trong oxit ở nhiệt độ cao.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng: D
+ Kim loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn; trong một chu kì, kiềm thổ đứng sau kim loại kiềm. Kim loại kiềm thổ gồm: Beri (Be); Magie (Mg); Canxi (Ca); Stronti ( Sr); Bari (Ba); Rađi (Ra) (Rađi là nguyên tố phóng xạ không bền)
+ Kim loại kiềm thổ là: Mg.
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Số kim loại thuộc nhóm IA là: K, Na, Li.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Cấu hình electron lớp ngoài cùng của các nguyên tố kim loại kiềm là ns1.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Thủy ngân ở điều kiện nhiệt độ phòng tồn tại ở thể lỏng và rất độc, muốn thu được thủy ngân thì người ta rắc bột lưu huỳnh lên chỗ nhiệt kế bị vỡ để thu hết được lượng thủy ngân rơi ra ngoài.
Thủy ngân tác dụng với lưu huỳnh ngay điều kiện thường:
Hg + S → HgS.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Người ta thường bảo quản kim loại kiềm bằng cách ngâm trong dầu hỏa.
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Để loại bỏ lớp cặn (CaCO3; MgCO3) trong ấm đun nước lâu ngày người ta có thể dùng giấm ăn.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có hiện tượng kết tủa trắng, sau đó kết tủa tan dần.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CaCO3↓ + CO2 + H2O → Ca(HCO3)2
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng: C
+ Phương pháp nhiệt luyện để điều chế kim loại là dùng chất khử mạnh như CO, H2, C, Al để khử ion kim loại trong oxit ở nhiệt độ cao.
+ Phương pháp nhiệt luyện được dùng điều chế các kim loại sau Al trong dãy hoạt động.
Dãy kim loại có thể được điều chế từ oxit, bằng phương pháp nhiệt luyện là: Fe, Cu, Ni.
Câu 17:
Kim loại tan trong dung dịch NaOH là
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Al tan được trong dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng: B
K2SO4 và Ca(NO3)2 không phản ứng với HCl.
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.
Ba(OH)2 + 2HCl → BaCl2 + 2H2O.
Câu 19:
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Ta dùng dãy các chất Ca(OH)2 vừa đủ , Na3PO4; Na2CO3 có thể làm mất tính cứng tạm thời của nước
Ca(OH)2 + M(HCO3)2 → CaCO3↓ + MCO3↓ + 2H2O
3Mg(HCO2)2 + 2Na3PO4 → Mg3(PO4)2↓ + 6NaHCO3
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + 2NaHCO3
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Kim loại Cu không khử được Fe2+ trong dung dịch.
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2
Cấu hình e của X là: 1s22s22p63s2
Vậy X thuộc chu kỳ 3 (do có 3 lớp electron); nhóm IIA (do 2 electron hóa trị, nguyên tố s);
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Chất X được dùng làm thuốc giảm đau dạ dày công thức của X là NaHCO3
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Phương trình hoá học thể hiện cách điều chế Cu theo phương pháp thuỷ luyện là:
Fe + CuSO4 → Cu + FeSO4.
Câu 24:
Dẫn khí CO dư qua hỗn hợp bột gồm MgO, CuO, Al2O3 và FeO, nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Số oxit kim loại trong Y là
 Xem đáp án
Xem đáp án
Đáp án đúng: C
CO khử được các oxit kim loại đứng sau Al trong dãy điện hóa;
Oxit kim loại trong Y thu được là MgO và Al2O3.
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Các kim loại kiềm dẫn điện tốt, có khối lượng riêng nhỏ và độ cứng tương đối thấp.Câu 26:
Thí nghiệm nào sau đây chỉ xảy ra ăn mòn hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Nhúng thanh Zn vào dung dịch H2SO4 loãng chỉ xảy ra ăn mòn hóa học.
Zn + H2SO4 → ZnSO4 + H2
Câu 27:
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Nguyên liệu chính dùng để sản xuất nhôm trong công nghiệp bằng phương pháp điện phân là quặng boxit.
Thành phần chính của quặng boxit là Al2O3.
Câu 28:
 Xem đáp án
Xem đáp án
Đáp án đúng: B
Kim loại Al không phản ứng với HNO3 đặc, nguội.
Câu 29:
Cho các phát biểu sau:
(1) Các oxit của kim loại kiềm thổ phản ứng với CO tạo thành kim loại.
(2) Các kim loại Ca, Fe, Al và Na chỉ điều chế được bằng phương pháp điện phân nóng chảy.
(3) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(4) Cho Mg vào dung dịch FeCl3 dư, không thu được Fe.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng: A
(1) Sai vì các oxit của kim loại kiềm thổ không bị khử bởi CO.
(2) Sai vì Fe không điều chế bằng phương pháp điện phân nóng chảy.
(3) Sai vì K không khử ion Ag+ thành Ag.
(4) Đúng vì Mg + 2FeCl3 (dư) → MgCl2 + 2FeCl2
Câu 30:
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Có nOH- = 2 = 0,06 mol
Số mol H+ cần để trung hòa một phần hai dung dịch A là:
nH+ = = 0,03 mol
Vậy V = = 0,3 (lít) = 300 ml.
Câu 31:
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Phương trình phản ứng:
M + 2H2O →M(OH)2 + H2
Suy ra = nM = 0,25 mol
Vậy M = 40g (Ca).
Câu 32:
 Xem đáp án
Xem đáp án
Đáp án đúng: A
= 0,15 (mol)
Cho Ag và Al phản ứng với HCl dư, chỉ có Al tham gia phản ứng
Suy ra mAl = 0,1.27 = 2,7 (g)
Vậy %Al = = 54,0%
Câu 33:
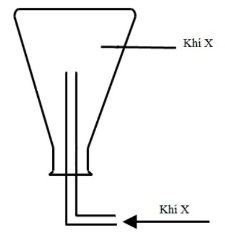
Thí nghiệm đó là
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Hình vẽ mô tả thí nghiệm: Cho dung dịch H2SO4 loãng vào bình đựng hạt kim loại Zn.
Zn + H2SO4 (loãng) → ZnSO4 + H2
Vì bình khí úp ngược nên khí thu được nhẹ hơn không khí (MX < 29)
Vậy X là H2.
Câu 34:
Tiến hành các thí nghiệm sau:
(1) Cho Mg vào dung dịch FeCl3 dư
(2) Cho Na vào dung dịch CuSO4
(3) Cho Cu vào dung dịch AgNO3
(4) Cho dung dịch AgNO3 dư vào dung dịch FeCl3
(5) Cho khí CO dư qua CuO nung nóng.
Số thí nghiệm có tạo ra kim loại là Xem đáp án
Xem đáp án
Đáp án đúng: A
Thí nghiệm có tạo ra kim loại là: (3), (5)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
CuO + CO Cu + CO2
Câu 35:
 Xem đáp án
Xem đáp án
Đáp án đúng: C
Độ giảm khối lượng = (65 – 64).0,1 = 0,1 gam.
Câu 36:
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Ta có: = 0,2 mol, nOH- = 1.0,12.2 + 1.0,06.1 = 0,3 mol
= 0,12.1 = 0,12 mol
Mà 1< = 1,5 < 2
Suy ra phản ứng tạo 2 muối
Áp dụng công thức
= 0,3 – 0,2 = 0,1 mol < 0,12 mol
Suy ra = 0,1 mol
Vậy m = 197.0,1 = 19,7 gam.
Câu 37:
Giả sử cho 7,28 gam bột Fe vào 150 ml dung dịch AgNO3 2M. Sau khi phản ứng kết thúc, lọc bỏ chất rắn, cô cạn dung dịch thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Có nFe = = 0,13 mol
= 0,15.2 = 0,3 mol
Dung dịch sau phản ứng gồm
Fe2+ có n = 0,13 - 0,04 = 0,09 mol
Fe3+ = 0,04 mol và NO3- có n = 0,3 mol
Vậy m = = 25,88 g.
Câu 38:
 Xem đáp án
Xem đáp án
Đáp án đúng: A
Đặt nHCl = 2x suy ra = x
Bảo toàn H ta có: = 2x
⇒ Y gồm kim loại (m gam) và O (2x mol)
⇒ mY = m + 16.2x = 16,2 (1)
Lại có mmuối = m + 35,5.2x + 96x = 43,2 (2)
Từ (1) và (2) có: m = 9,8 và x = 0,2
Câu 39:
 Xem đáp án
Xem đáp án
Đáp án đúng: D
nFe = = 0,05 (mol)
nCu = = 0,025 (mol
= 0,05 (mol); nHCl = 0,5.0,4 = 0,2 (mol) ⇒ nH+ = 0,25 (mol)
Phương trình ion rút gọn:
Vậy sau phản ứng (1) Fe và NO3- đã phản ứng hết
Cho dung dịch X vào dung dịch AgNO3 có phản ứng
Suy ra dư = 0,05 - 0,0375 = 0,0125 (mol)
Vậy khối lượng kết tủa thu được là:
m↓ = mAgCl + mAg = 0,2.143,5 + 0,0125.108 = 30,05 (g)
Câu 40:
 Xem đáp án
Xem đáp án
Ta có: = 0,15 mol
Phương trình điện phân:
2AgNO3 + H2O → 2Ag + 2HNO3 + O2
Khi cho Fe vào X thu được hỗn hợp kim loại chứng tỏ trong X có chứa AgNO3 dư;
Giải hệ: x + y = 0,15
Và 108.y - (0,375x + 0,5y).56 = 14,5 - 12,6 = 1,9
Suy ra x = 0,1 mol
Vậy t = = 3600 giây = 60 phút = 1 giờ.
