Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 8)
-
7189 lượt thi
-
28 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
Cho hình vẽ như sau. Cho biết hiện tượng xảy ra trong bình tam giác?
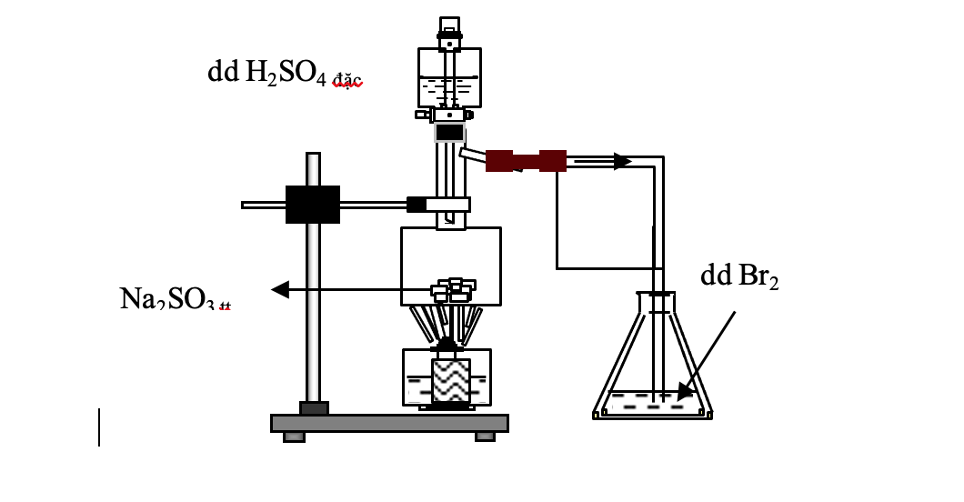
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Hiện tượng: dung dịch Br2bị mất màu nâu.
Phương trình hóa học:
Na2SO3+ H2SO4→ Na2SO4+ SO2↑ + H2O
SO2+ Br2+ 2H2O → 2HBr + H2SO4
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
nFe= 0,2 (mol);  = 0,15 (mol).
= 0,15 (mol).
Coi hỗn hợp X gồm Fe (0,2 mol) và O.
Bảo toàn e: 3nFe= 2 + 2nO→ nO= 0,15 (mol).
+ 2nO→ nO= 0,15 (mol).
→ 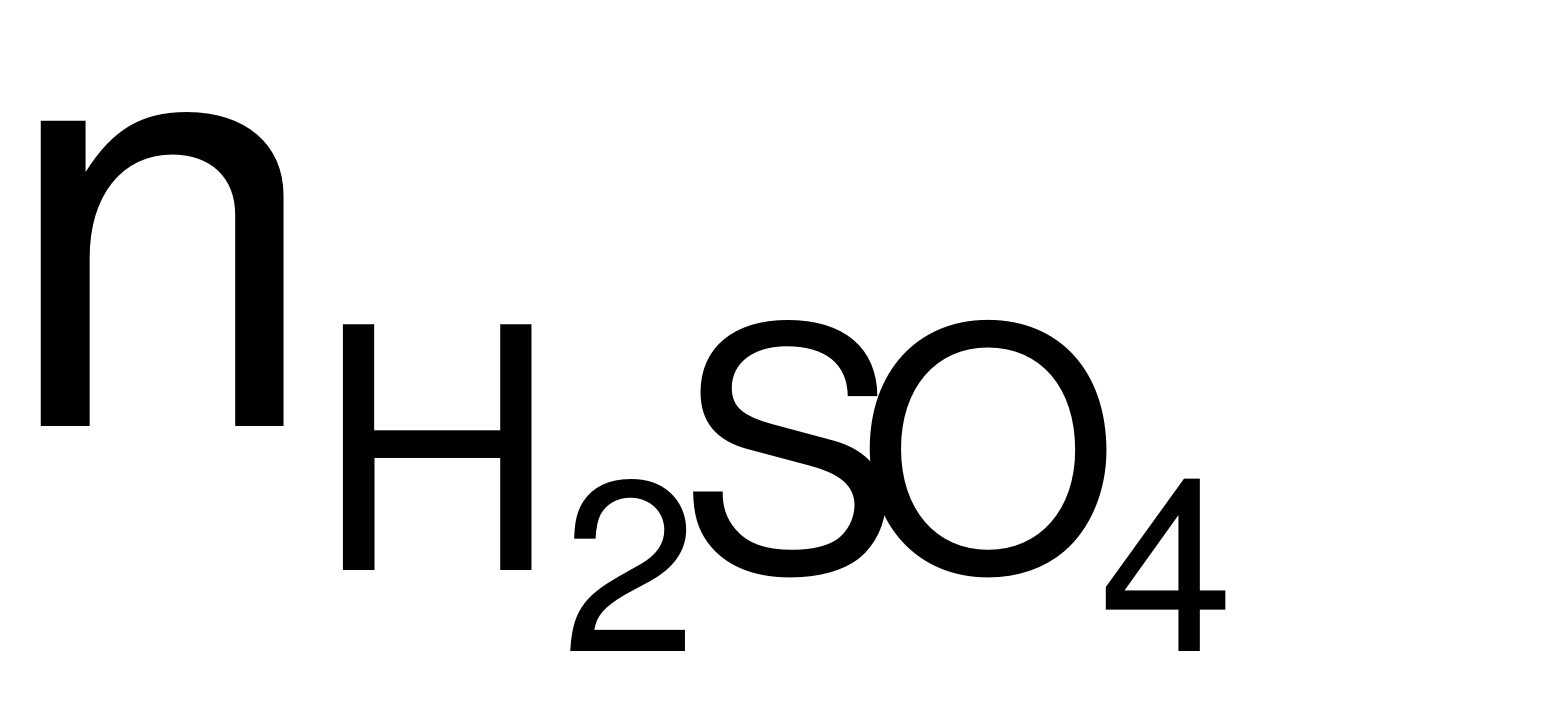 = 3
= 3 + 2nO= 30,15 + 20,15 = 0,75 (mol).
+ 2nO= 30,15 + 20,15 = 0,75 (mol).
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
 = 0,1 (mol); nNaOH= 0,2 (mol).
= 0,1 (mol); nNaOH= 0,2 (mol).
Nhận xét: 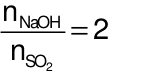 → chỉ tạo muối Na2SO3.
→ chỉ tạo muối Na2SO3.
SO2+ 2NaOH → Na2SO3+ H2O (SO2và NaOH phản ứng vừa đủ).
→ 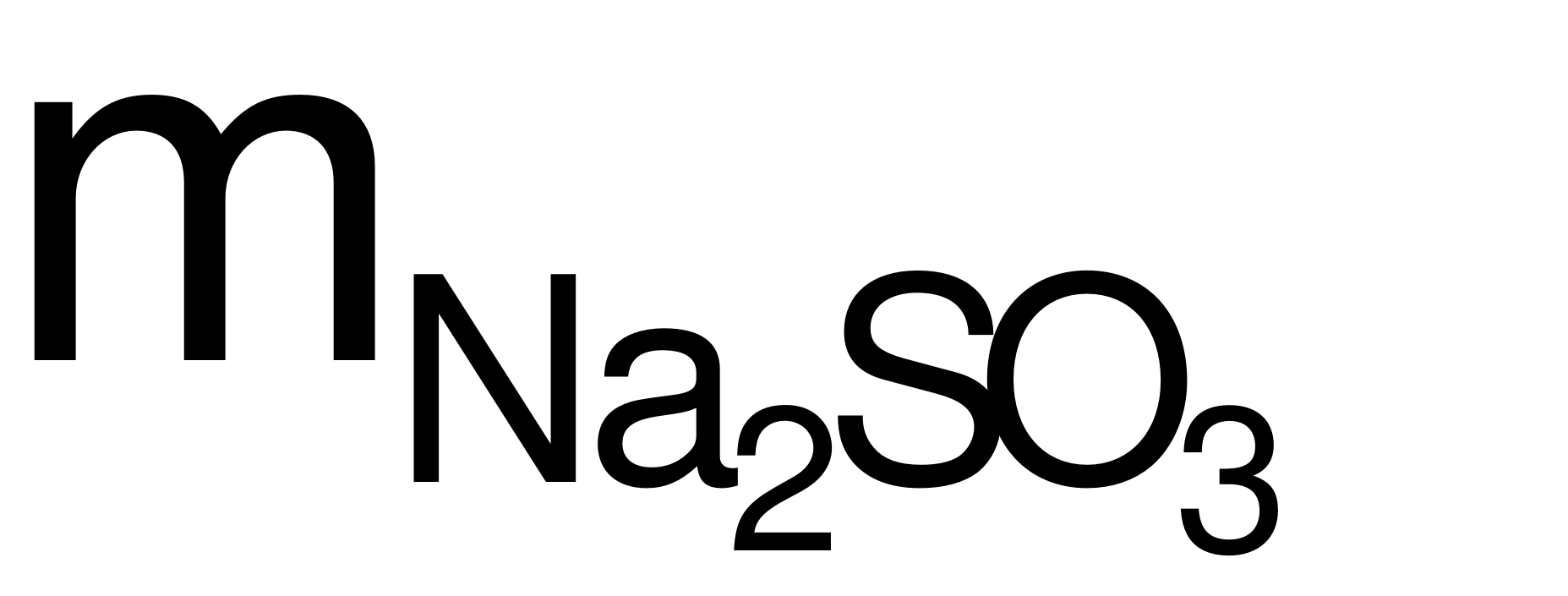 = 0,1126 = 12,6 (gam).
= 0,1126 = 12,6 (gam).
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Viên than tổ ong có nhiều lỗ để tăng diện tích tiếp xúc của than với oxi, làm tăng tốc độ của phản ứng đốt than.
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Tốc độ phản ứng của kẽm bột nhanh hơn kẽm hạt là do sự ảnh hưởng của yếu tố diện tích bề mặt tiếp xúc (khi tăng diện tích tiếp xúc của các chất phản ứng, tốc độ phản ứng tăng).
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Ở trạng thái cân bằng, không phải là phản ứng dừng lại, mà phản ứng thuận và phản ứng nghịch vẫn xảy ra, nhưng với tốc độ bằng nhau.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Thuốc thử đặc trưng để nhận biết ra hợp chất halogenua trong dung dịch là AgNO3.
Không có hiện tượng gì là muối florua (F-) hoặc HF.
Xuất hiện kết tủa trắng muối clorua (Cl-) hoặc HCl.
Ví dụ : AgNO3+ NaCl → AgCl↓ + NaNO3
Xuất hiện kết tủa màu vàng nhạt muối bromua (Br-) hoặc HBr.
Ví dụ : AgNO3+ NaBr → AgBr↓ + NaNO3
Xuất hiện kết tủa màu vàng muối iotua (I-) hoặc HI.
Ví dụ : AgNO3+ NaI → AgI↓ + NaNO3
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Axit sufuric (H2SO4) đặc, nguội không phản ứng với Al, Fe, Cr.
→ Axit sufuric đặc, nguội có thể đựng trong bình chứa làm bằng Al.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
nX= 0,35 (mol).
Bảo toàn khối lượng:
mX+ mY= mZ→ mX= 30,1 – 11,1 = 19 (gam).
Ta có hệ phương trình:
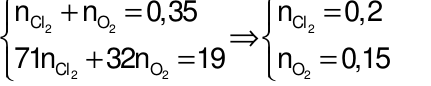 .
.
Gọi số mol của Mg và Al trong Y lần lượt là x, y (mol).
→ 24x + 27y = 11,1 (1)
Bảo toàn e: 2nMg+ 3nAl = 2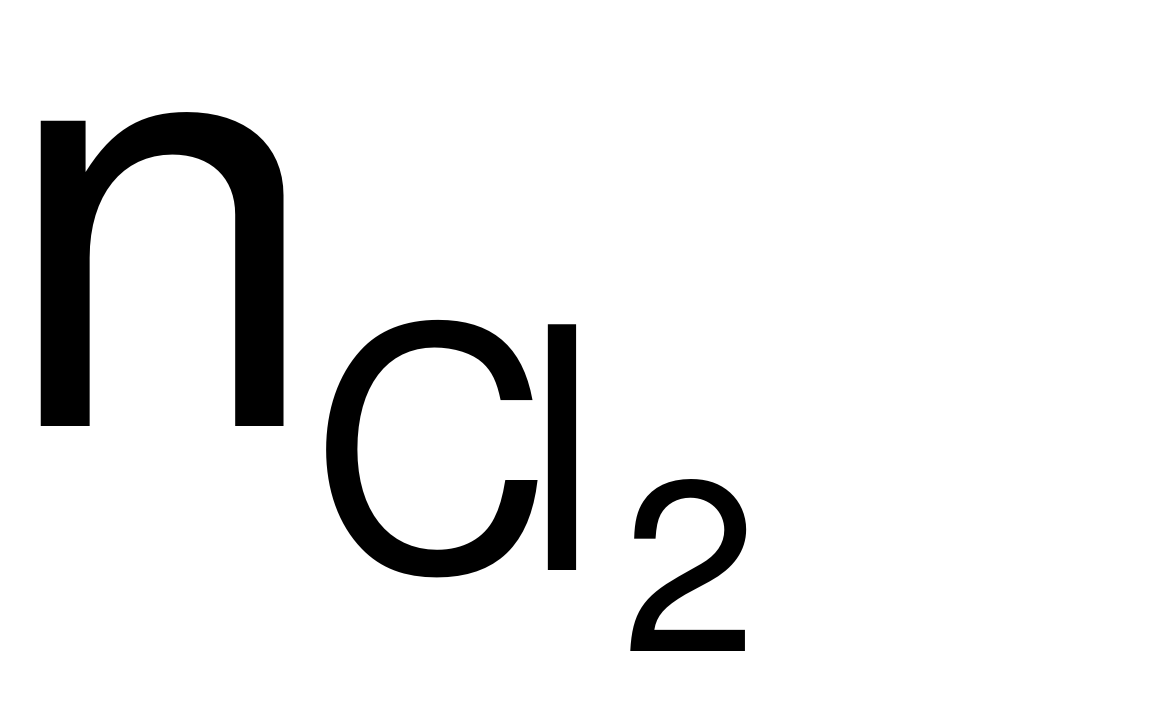 + 4
+ 4 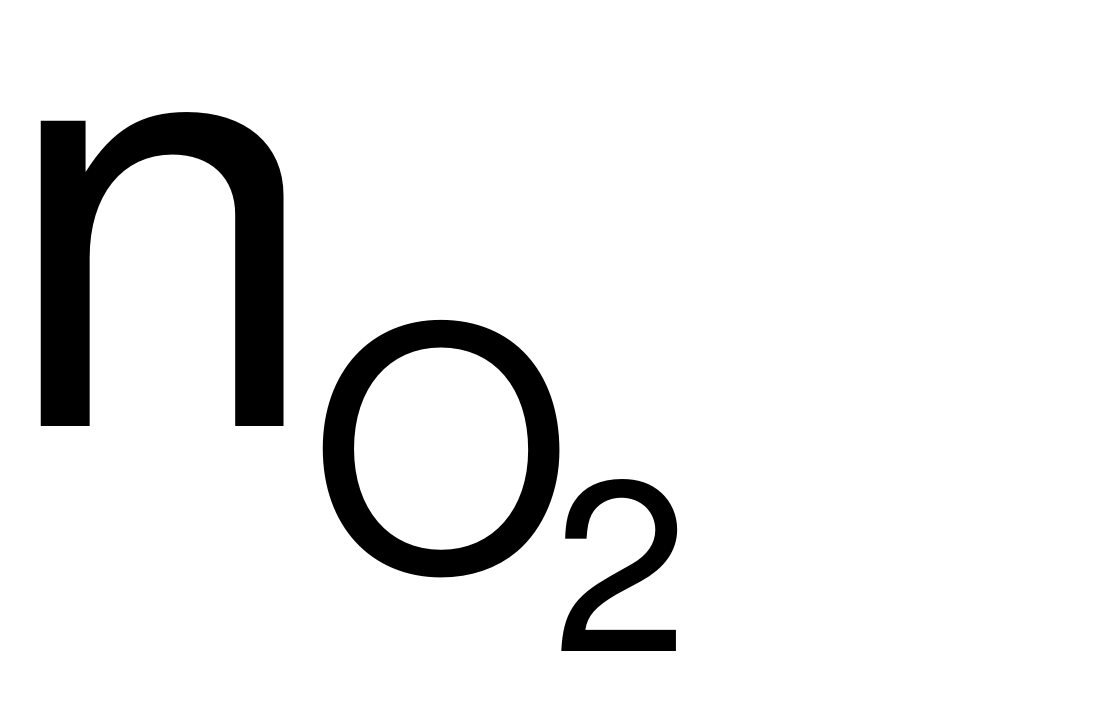
→ 2x + 3y = 1 (2)
Từ (1) và (2) suy ra: x = 0,35; y = 0,1.
→ %mAl= 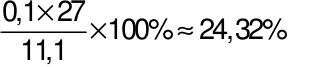 .
.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Cân bằng hóa học: CO(k)+ H2O(k)→ CO2(k)+ H2(k)∆H< 0.
Thay đổi nồng độ khí H2hoặc CO2thì cân bằng sẽ chuyển dịch theo chiều làm tăng nồng độ khí H2hoặc CO2chiều thuận.
Thay đổi nồng độ H2O: khi tăng (hoặc giảm) nồng độ H2O cân bằng sẽ dịch chuyển theo chiều làm giảm (hoặc tăng) nồng độ H2O chiều thuận (hoặc chiều nghịch).
Thay đổi nhiệt độ: ∆H< 0 phản ứng tỏa nhiệt.
Thay đổi nhiệt độ sẽ làm chuyển dịch cân bằng hóa học.
Thay đổi áp suất không làm chuyển dịch cân bằng do tổng số mol khí của hệ trước phản ứng bằng sau phản ứng.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Oleum có công thức tổng quát là H2SO4.nSO3.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Chỉ có kim loại Fe phản ứng với dung dịch HCl.
Fe + 2HCl FeCl2+ H2
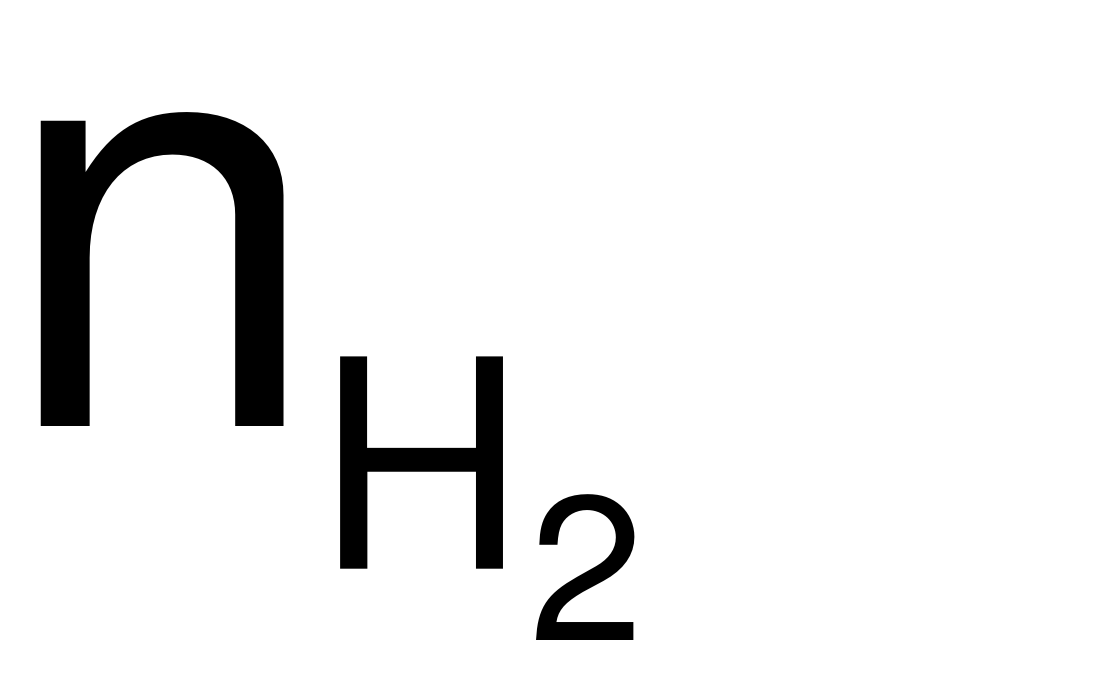 = nFe= 0,15 (mol)
= nFe= 0,15 (mol)
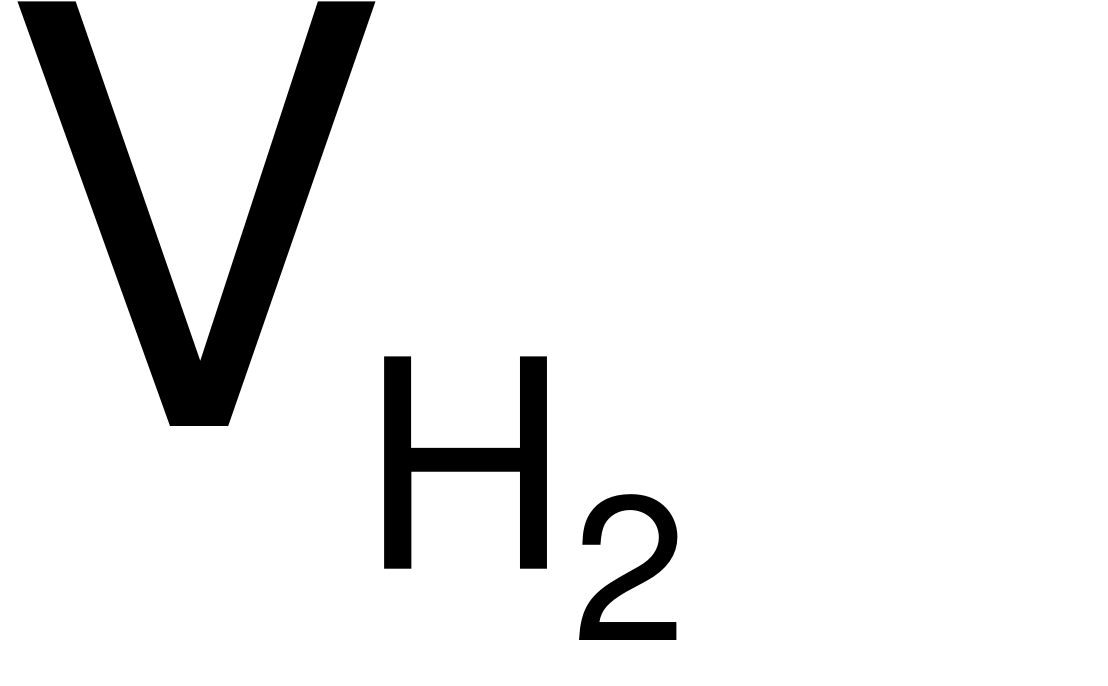 = 0,15×22,4 = 3,36 (lít).
= 0,15×22,4 = 3,36 (lít).
Câu 13:
MnO2+ (A) → MnCl2+ (B)↑ + (C);
(B) + H2→ (A);
(A) + (D) → FeCl2+ H2.
Các chất (A), (B), (C), (D) lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
(A): HCl; (B): Cl2; (C): H2O; (D): Fe.
Phương trình hóa học:
MnO2+ 4HClđặc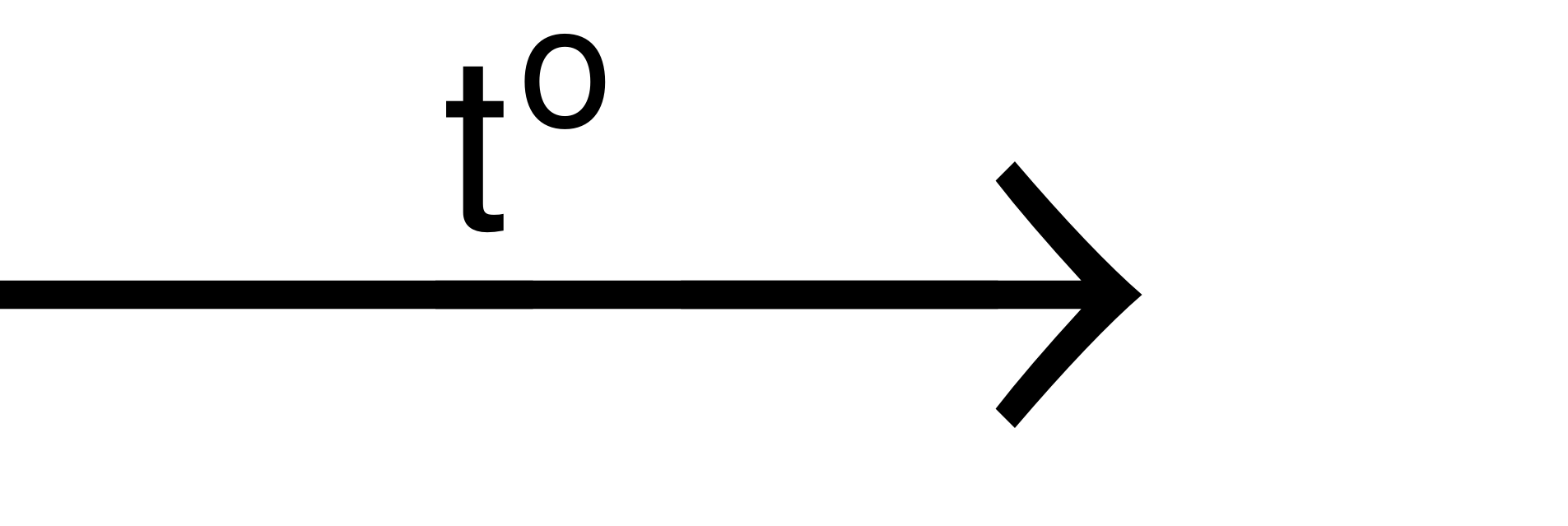 MnCl2+ Cl2+ 2H2O
MnCl2+ Cl2+ 2H2O
Cl2+ H2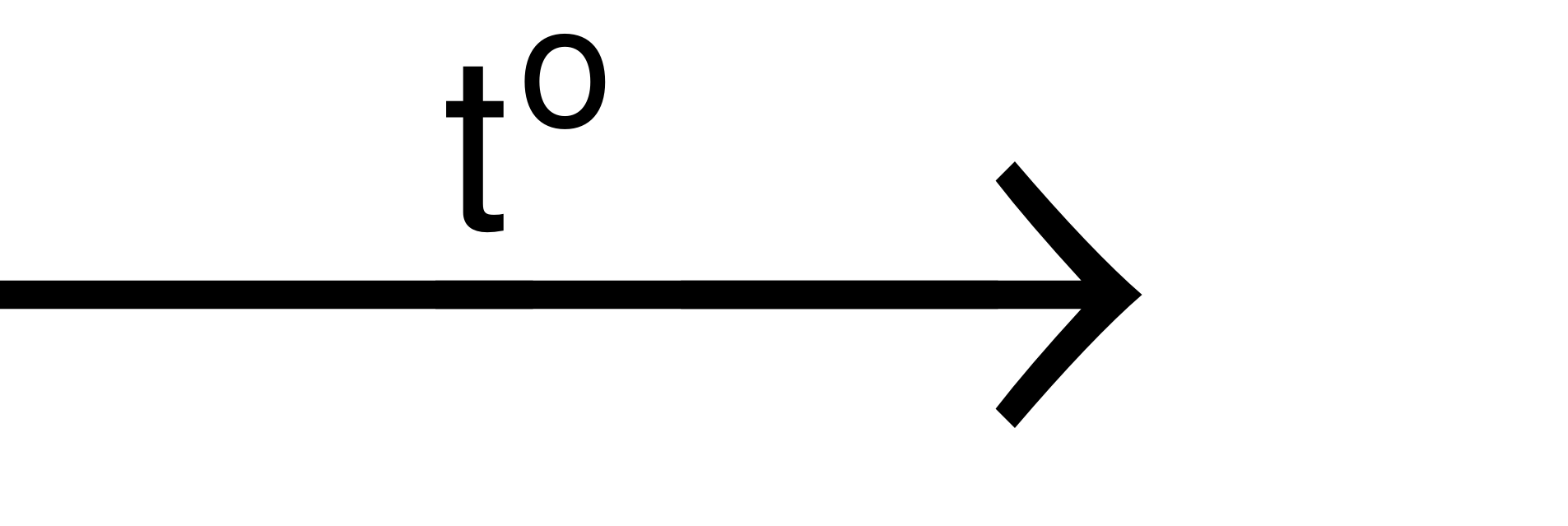 2HCl
2HCl
2HCl + Fe FeCl2+ H2
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Phương trình hóa học:
NaClrắn+ H2SO4 (đặc) 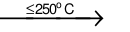 NaHSO4+ HCl
NaHSO4+ HCl
2NaClrắn+ H2SO4 (đặc) 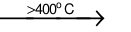 Na2SO4+ 2HCl
Na2SO4+ 2HCl
Khí sinh ra là HCl.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
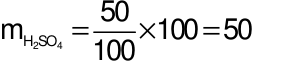 (gam).
(gam).
Gọi khối lượng H2O cần thêm để pha loãng là x (gam).
Ta có: 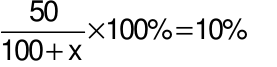 x = 400.
x = 400.
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cl2+ H2O  HCl + HClO
HCl + HClO
Axit hipoclorơ (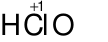 ) có tính oxi hóa rất mạnh, nó phá hủy các chất màu, vì thế clo ẩm có tác dụng tẩy màu.
) có tính oxi hóa rất mạnh, nó phá hủy các chất màu, vì thế clo ẩm có tác dụng tẩy màu.
Câu 17:
Cân bằng chuyển dịch theo chiều nghịch khi
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Khi giảm nhiệt độ, cân bằng sẽ chuyển dịch theo chiều làm tăng nhiệt độ chiều nghịch (do ∆H >0: phản ứng thuận là phản ứng thu nhiệt).
Loại A vì: khi giảm nồng độ Cl2, cân bằng hóa học chuyển dịch theo chiều làm tăng nồng độ Cl2chiều thuận.
Loại B vì: khi giảm áp suất, cân bằng hóa học chuyển dịch theo chiều làm tăng áp suất chiều thuận.
Loại C vì: khi thêm PCl5, cân bằng hóa học sẽ chuyển dịch theo chiều làm giảm PCl5chiều thuận.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phân biệt: CO2, SO2và O2.
Dùng dung dịch Br2: thấy dung dịch Br2nhạt màu là SO2; không hiện tượng là CO2và O2.
SO2+ Br2+ 2H2O 2HBr + H2SO4
Dùng dung dịch nước vôi trong: thấy xuất hiện kết tủa trắng là CO2; không hiện tượng là O2.
CO2+ Ca(OH)2CaCO3+ H2O
Câu 19:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ trung bình của phản ứng tính theo N2O5 là:
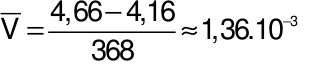 (mol/l.s)
(mol/l.s)
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
nS= 0,15 (mol); nNaOH= 0,25 (mol).
Phương trình hóa học: S + H2 H2S
H2S
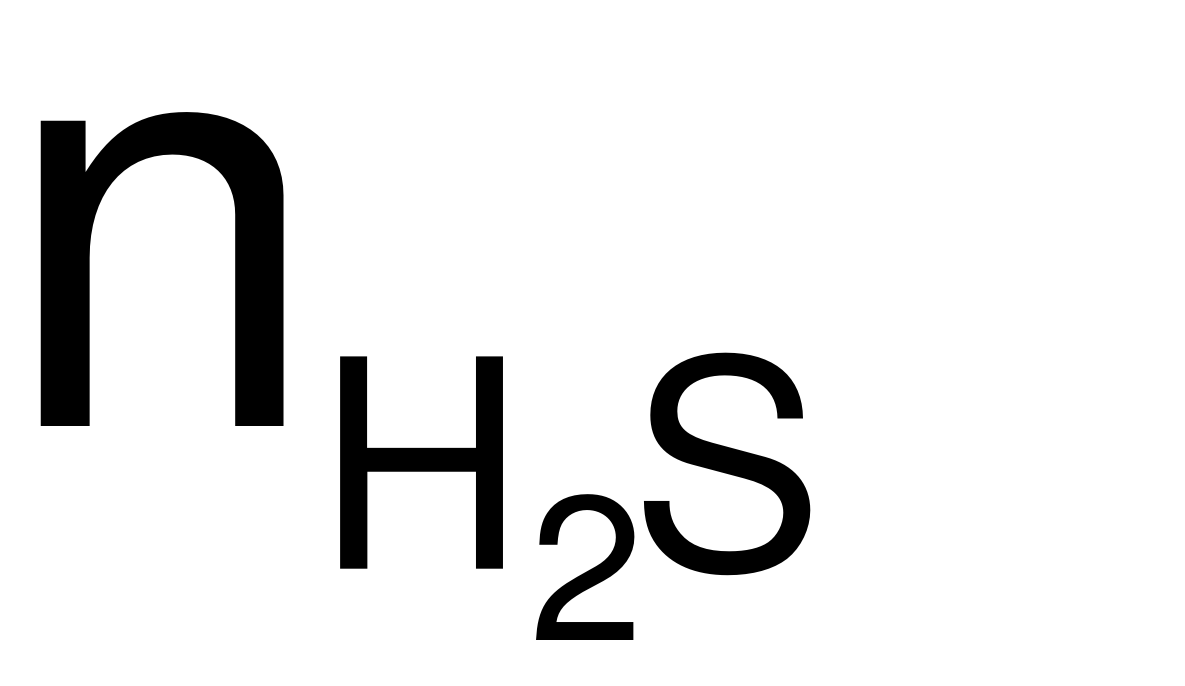 = nS= 0,15 (mol).
= nS= 0,15 (mol).
Nhận xét: 1 < 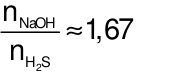 < 2 tạo 2 muối: NaHS (x mol) và Na2
< 2 tạo 2 muối: NaHS (x mol) và Na2
H2S + NaOH NaHS + H2O
x x x (mol)
H2S + 2NaOH Na2S + 2H2O
y 2y y (mol)
Ta có hệ phương trình:
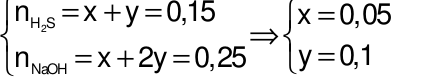 .
.
mrắn= mNaHS+ 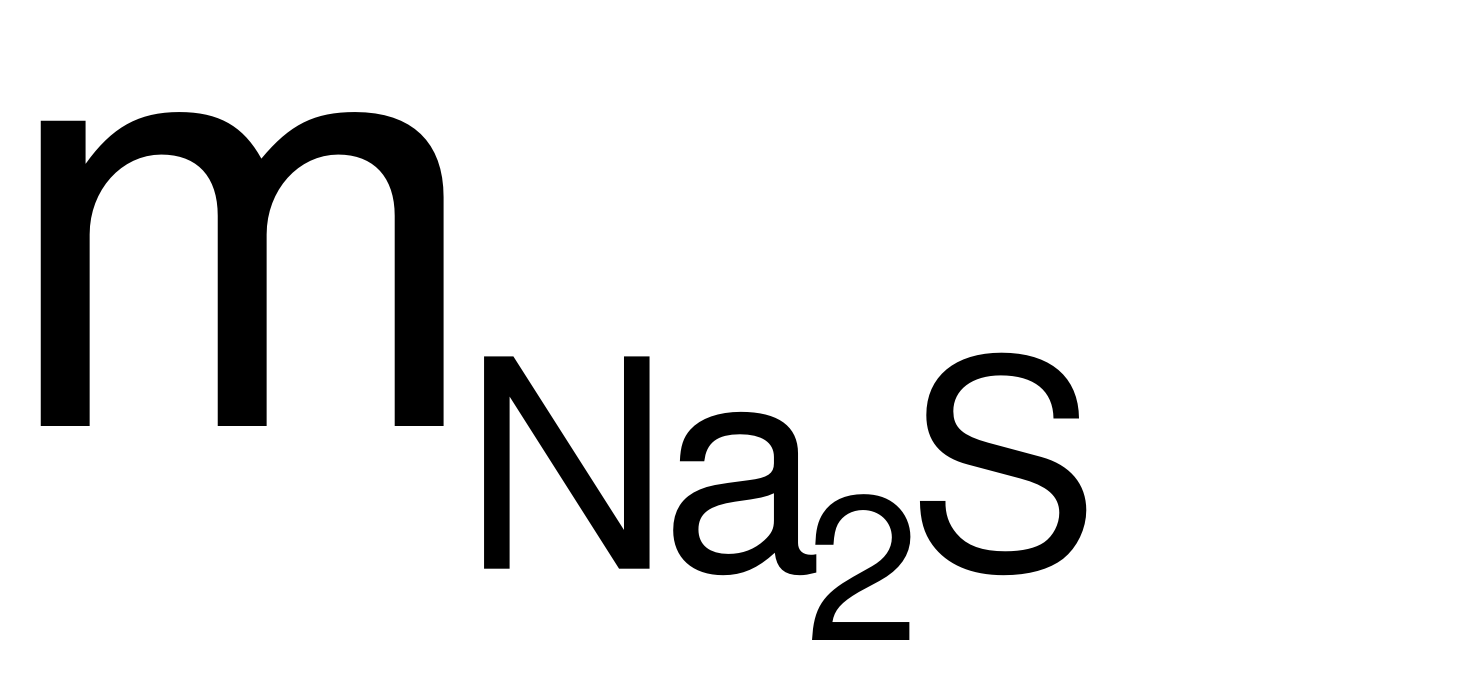 = 0,05×56 + 0,1×78 = 10,6 (gam).
= 0,05×56 + 0,1×78 = 10,6 (gam).
Câu 21:
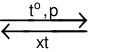 2SO3(k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2giảm đi. Phát biểu đúng khi nói về cân bằng này là
2SO3(k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2giảm đi. Phát biểu đúng khi nói về cân bằng này là Xem đáp án
Xem đáp án
Đáp án đúng là:A
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2giảm đi số mol của hỗn hợp khí tăng cân bằng chuyển dịch theo chiều chiều nghịch.
Phản ứng nghịch là phản ứng thu nhiệt (phản ứng thuận là phản ứng tỏa nhiệt).
Loại C và D.
Phát biểu đúng: Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
nHCl= 2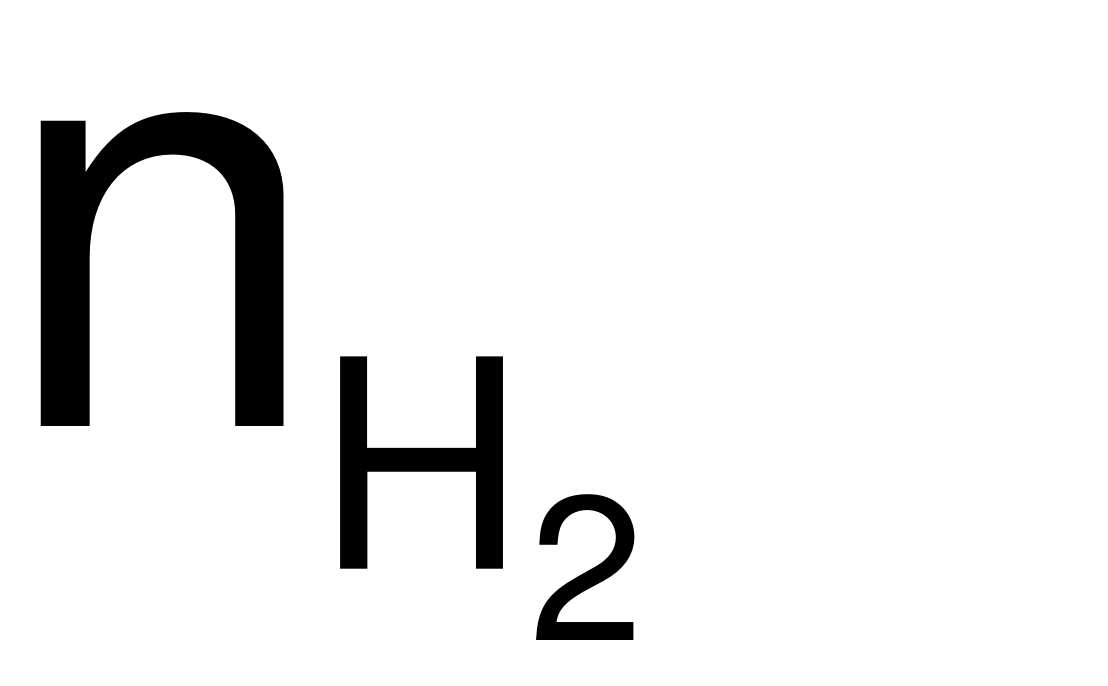 .
.
Bảo toàn khối lượng:
m(Mg, Al) + mHCl= mmuối+ 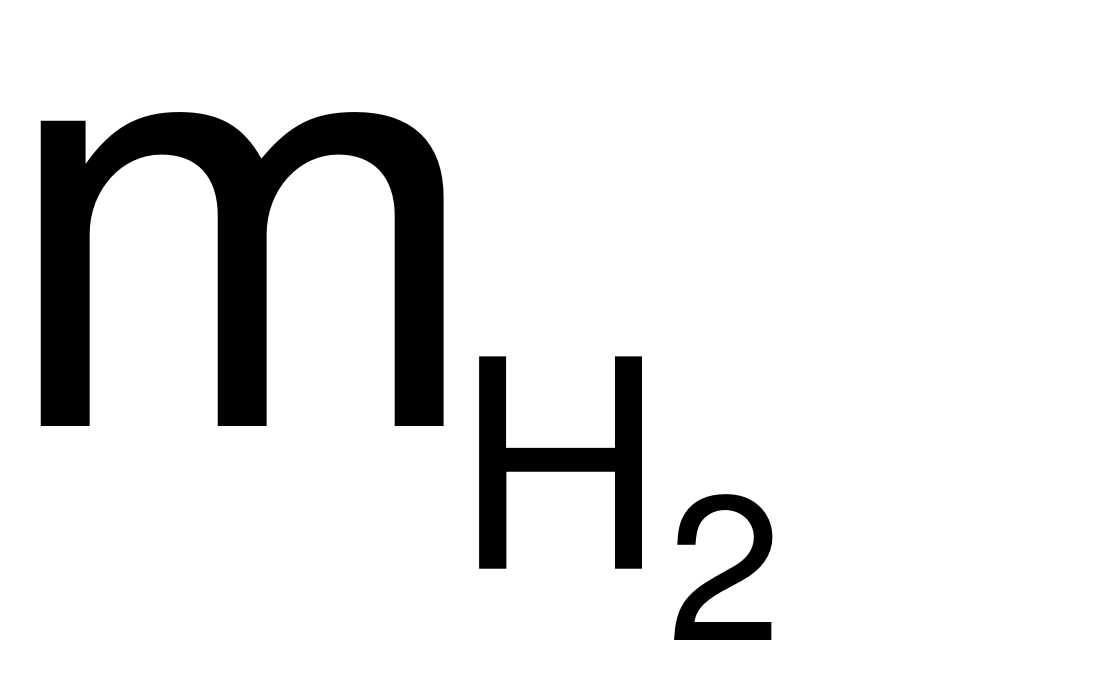
11,7 + 36,5×2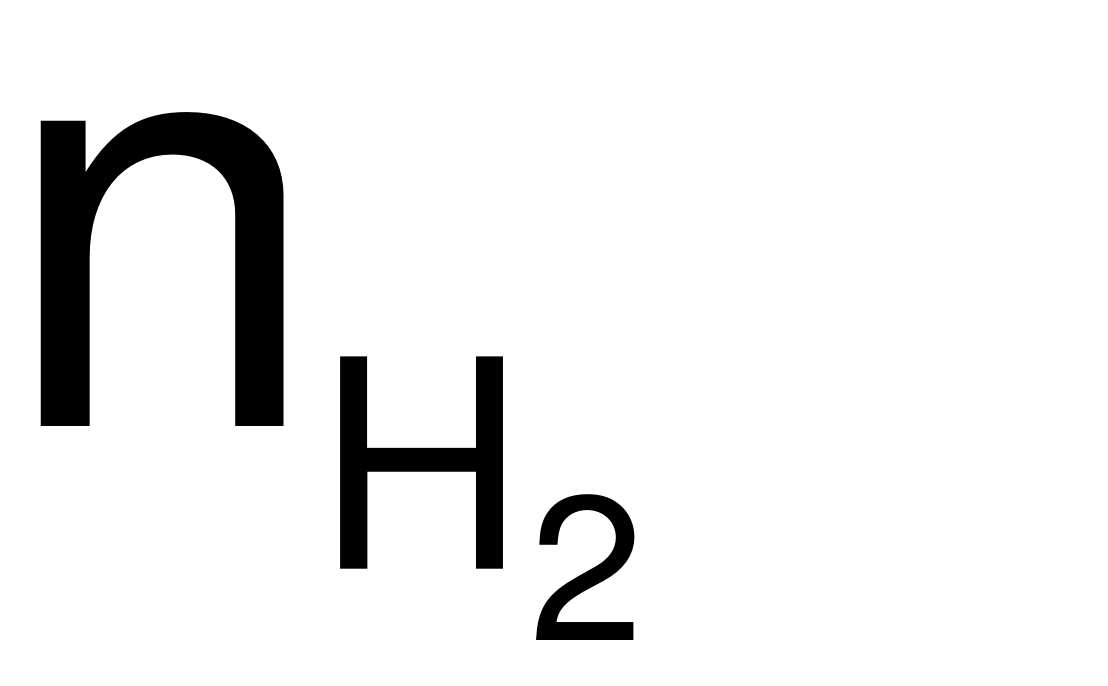 = 54,3 + 2×
= 54,3 + 2×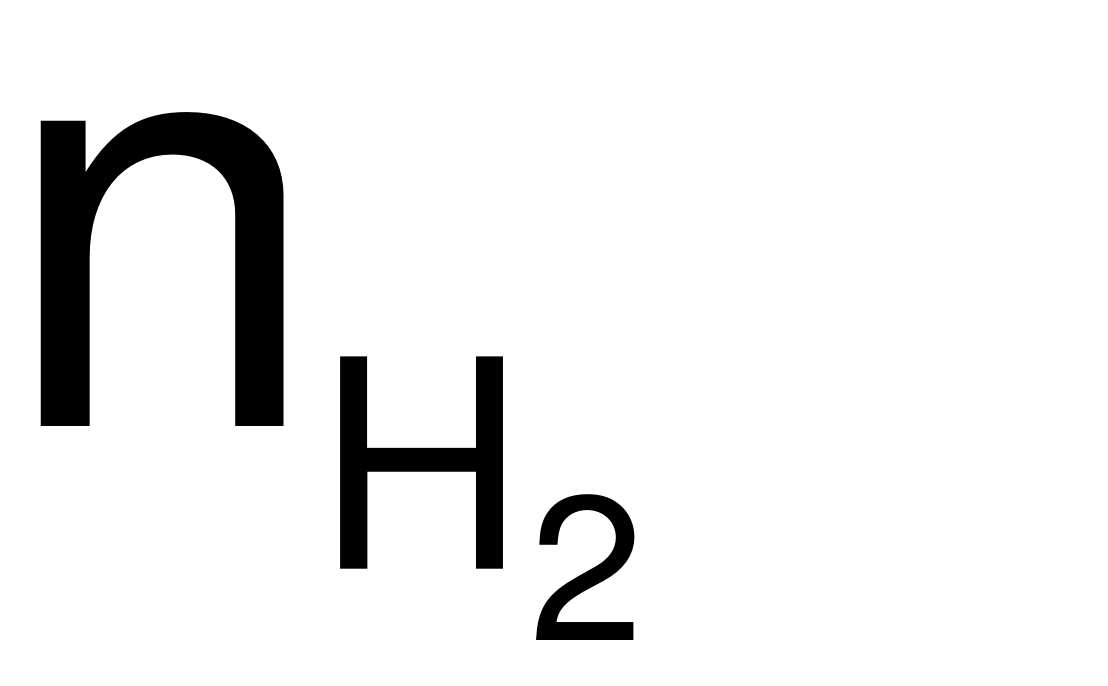
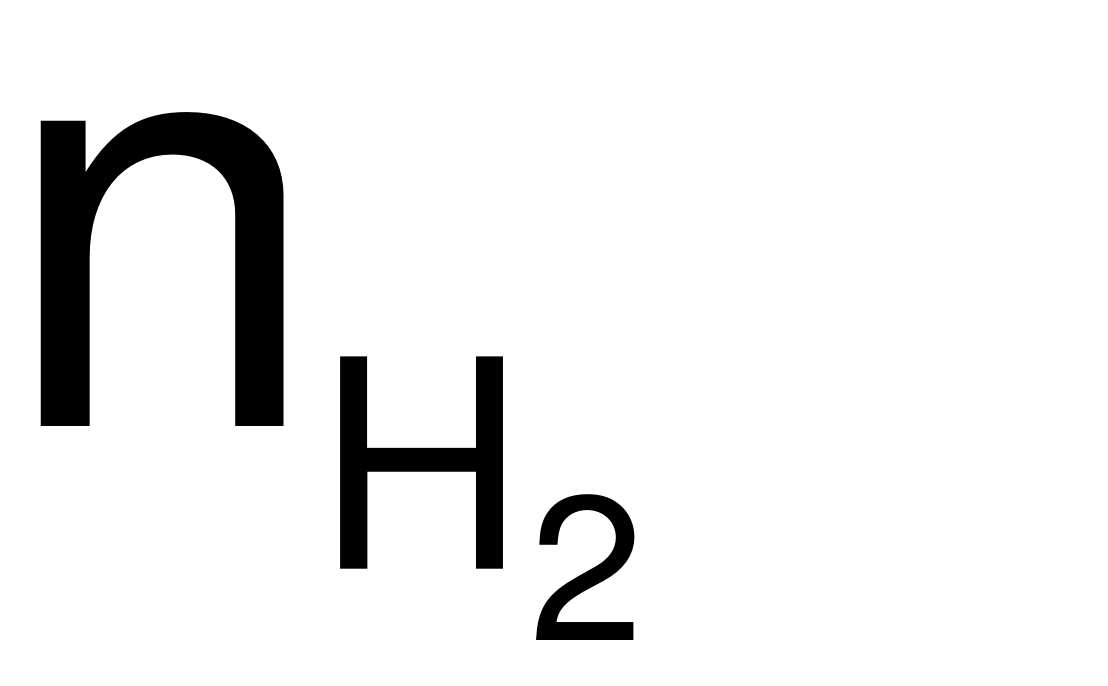 = 0,6 (mol)
= 0,6 (mol) 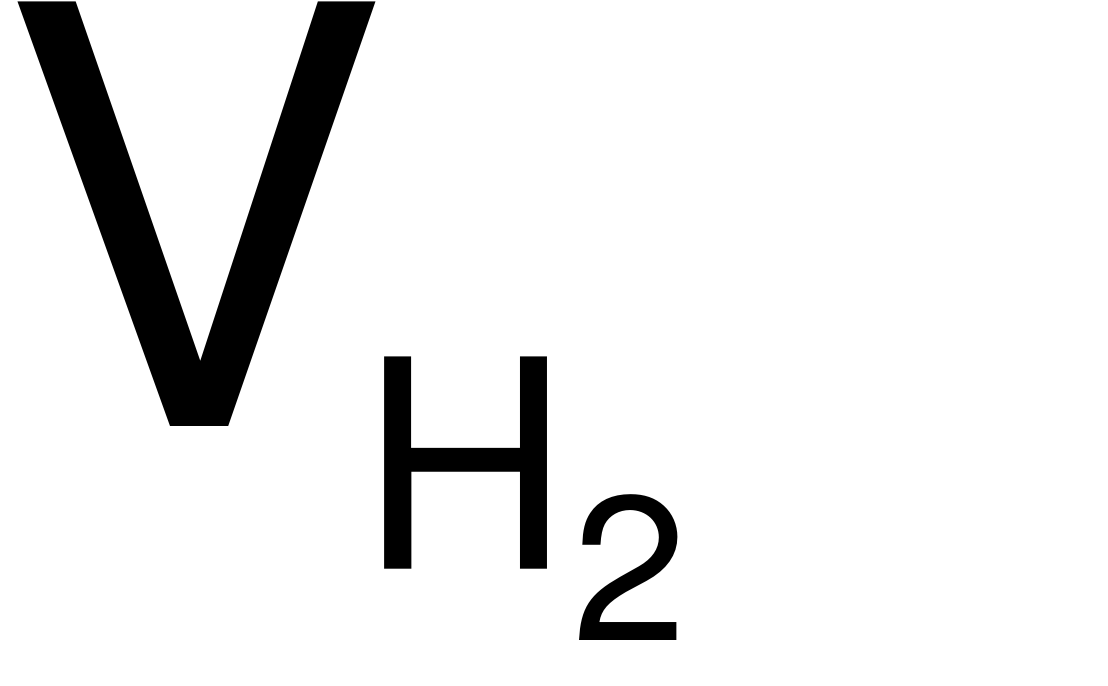 = 0,6×22,4 = 13,44 (lít).
= 0,6×22,4 = 13,44 (lít).
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Gọi công thức chung của 2 kim loại là  .
.
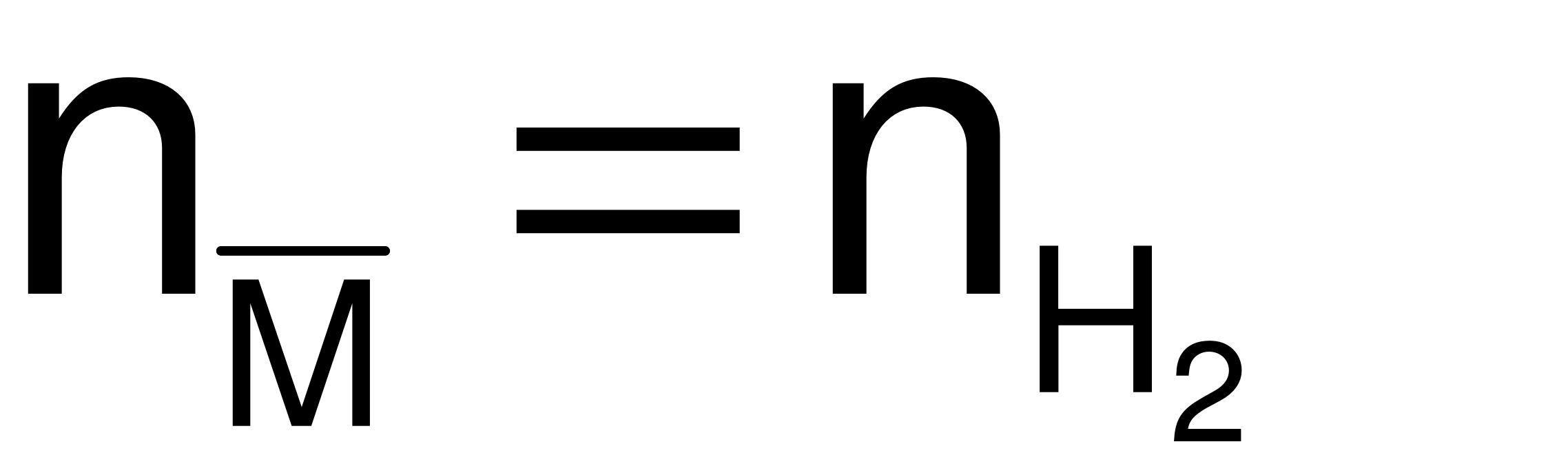 = 0,03 (mol)
= 0,03 (mol) 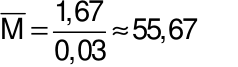 .
.
Hai kim loại đó là Ca (M = 40) và Sr (M = 88).
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Đơn chất I2là chất rắn (ở điều kiện thường) và có tính thăng hoa.
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
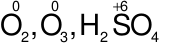 : chỉ có tính oxi hóa.
: chỉ có tính oxi hóa.
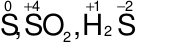 : vừa có tính oxi hóa, vừa có tính khử.
: vừa có tính oxi hóa, vừa có tính khử.
Tự luận. (3 điểm)
Câu 26:
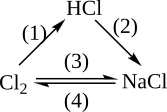
Hoàn thành sơ đồ chuyển hóa sau (ghi rõ điều kiện của phản ứng nếu có)
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
(1) Cl2+ H2![]() 2HCl
2HCl
(2) HCl + NaOH NaCl + H2O
(3) Cl2+ 2Na ![]() 2NaCl
2NaCl
(4) 2NaCl + 2H2O  2NaOH + H2+ Cl2
2NaOH + H2+ Cl2
Câu 27:
Cho 12 gam hỗn hợp gồm Cu và Fe tác dụng hoàn toàn với dung dịch H2SO4đặc, nóng dư thu được 5,6 lít khí SO2(điều kiện tiêu chuẩn). Tính khối lượng của Cu và Fe trong hỗn hợp ban đầu.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
![]() = 0,25 (mol).
= 0,25 (mol).
Gọi số mol của Cu và Fe trong hỗn hợp lần lượt là x, y (mol).
64x + 56y = 12 (1)
Bảo toàn e: 2nCu+ 3nFe= 2![]() 2x + 3y = 0,5 (2).
2x + 3y = 0,5 (2).
Từ (1) và (2) suy ra: x = 0,1; y = 0,1.
mCu= 0,1×64 = 6,4 (gam); mFe = 0,1×56 = 5,6 (gam).
Câu 28:
Cho cân bằng sau đây:N2(k) + 3H2(k) ⇄ 2NH3(k);![]() . Cân bằng sẽ chuyển dịch như thế nào khi thay đổi các yếu tố sau?
. Cân bằng sẽ chuyển dịch như thế nào khi thay đổi các yếu tố sau?
a) Thêm khí N2
c)Tăng nhiệt độ
d) Giảm áp suất
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
Cân bằng hóa học: N2(k) + 3H2(k) ⇄ 2NH3(k) ![]()
a) Thêm khí N2
Khi thêm khí N2, cân bằng hóa học sẽ chuyển dịch theo chiều làm giảm khí N2.
chiều thuận.
b) Lấy bớt khí NH3
Khi lấy bớt khí NH3, cân bằng hóa học sẽ chuyển dịch theo chiều làm tăng khí NH3 chiều thuận.
c) Tăng nhiệt độ
![]() Phản ứng thuận là phản ứng tỏa nhiệt.
Phản ứng thuận là phản ứng tỏa nhiệt.
Khi tăng nhiệt độ, cân bằng hóa học sẽ chuyển dịch theo chiều làm giảm nhiệt độ Phản ứng thu nhiệt chiều nghịch.
d) Giảm áp suất
Tổng số mol khí trước = 1 + 3 = 4; tổng số mol khí sau = 2.
Khi giảm áp suất của hệ, cân bằng hóa học sẽ chuyển dịch theo chiều làm tăng áp suất của hệ chiều nghịch.
