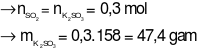Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 12)
-
7177 lượt thi
-
27 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Ở điều kiện thường:
- Clo là chất khí có màu vàng lục.
- Flo là chất khí có màu lục nhạt.
- Brom là chất lỏng có màu đỏ nâu.
- Iot là chất rắn dạng tinh thể có màu đen tím.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Do hoạt động hóa học mạnh nên Cl2chỉ tồn tại ở dạng hợp chất, chủ yếu là NaCl trong muối mỏ, nước biển.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Mg + 2HCl → MgCl2+ H2
CuO + 2HCl → CuCl2+ H2O
- Đáp án A loại vì Cu đứng sau H trong dãy hoạt động hoá học.
- Đáp án C loại vì Ag đứng sau H trong dãy hoạt động hoá học.
- Đáp án D loại vì BaSO4không tác dụng với HCl.
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Dựa vào lý thuyết bài: Hợp chất có oxi của clo
Nước Gia-ven
Nước Gia-ven
Cl2+ 2NaOH → NaCl + NaClO + H2OCâu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Dựa vào tính tan của muối bạc halgenua
- AgF là muối tan nhiều trong nước. Còn các muối AgCl, AgBr, AgI đều là kết tủa trong nước.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ta có: 
4FeS2+ 11O2 2Fe2O3+ 8SO2
2Fe2O3+ 8SO2
0,05 ← 0,1
⇒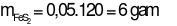
Câu 7:
Trong hợp chất nào sau đây, nguyên tố S khôngcó tính oxi hóa?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Xác định số oxi hoá của S trong từng hợp chất.

- Ở trên ta có thể thấy
trong Na2S thì số oxi hoá của S trong hợp chất là – 2 (số oxi hoá thấp nhất của S trong hợp chất) →Na2S không thể hiện tính oxi hoá.
Câu 8:
Tốc độ phản ứng là độ biến thiên nồng độ của
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Tốc độ phản ứng là biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Tốc độ tính theo chất sản phẩm bằng tốc độ tính theo chất phản ứng
Câu 9:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Đáp án A loại vì Brom ở điều kiện thường là chất lỏng, Iot ở điều kiện thường là chất rắn dạng tinh thể.
- Đáp án B loại vì từ Flo đến Iot, tính oxi hoá giảm dần.
- Đáp án D loại vì F2có màu nhạt nhất trong số các halogen.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cách 1:
Gọi số mol của Zn và Mg lần lượt là x và y
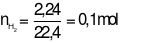
Phương trình phản ứng
Zn + 2HCl →ZnCl2+ H2
x → x x
Mg + 2HCl →MgCl2+ H2
y →y y
Theo bài ra ta có hệ phương trình:
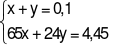
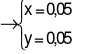
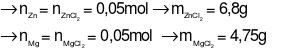
mmuối= 6,8 + 4,75 = 11,55 gam
Cách 2:
Áp dụng: mmuối= mKL+ mgốc axit= mKL + 71.nkhí
⇒ mmuối= 4,45 + 0,1.71 = 11,55 gam.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Nguyên tố Flo có độ âm điện lớn nhất trong nhóm halogen nên là phi kim có tính oxi hoá mạnh nhất. Khí Flo oxi hoá nước dễ dàng ở ngay nhiệt độ thường, hơi nước nóng bốc cháy khi tiếp xúc với khí Flo.
Câu 12:
(a) Axit flohiđric là axit yếu.
(b) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
(d) Trong hợp chất, các halogen đều có số oxi hóa: -1, +1, +3, +5 và +7.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Các phát biểu đúng là: (a), (b), (c)
Phát biểu (d) sai vì Flo chỉ có số oxi hóa -1 trong hợp chất.
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Gọi kim loại hoá trị II là M
Áp dụng định luật bảo toàn khối lượng ta có:
mchất rắn = 
 = mchất rắn– mM = 3,24 – 2,6 = 0,64 gam
= mchất rắn– mM = 3,24 – 2,6 = 0,64 gam
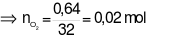
Phương trình hoá học:
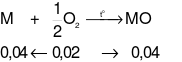
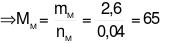
Vậy Kim loại M là Kẽm (Zn).
Câu 14:
Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Lưu huỳnh thể hiện tính oxi hoá khi tác dụng với Al
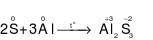
Câu 15:
Hấp thụ hoàn toàn V lít khí H2S (đktc) vào 450 ml dung dịch NaOH 1,2M, thu được dung dịch chứa hai muối có số mol bằng nhau. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
![]()
Hai muối được tạo thành là NaHS và Na
2S có số mol bằng nhau.
Gọi số mol của ![]()
BTNT Na ta có: ![]()
![]()
BTNT S ta có: ![]()
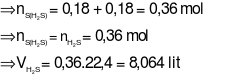
Câu 16:
4NH3 (k) + 3O2 (k) ⇄ 2N2 (k) + 6H2O(h)  < 0
< 0
Cân bằng sẽ chuyển dịch theo chiều thuận khi
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
 < 0
< 0  Đây là phản ứng toả nhiệt
Đây là phản ứng toả nhiệt
- Đáp án A loại vì cân bằng chuyển dịch theo chiều thuận khi giảm nhiệt độ.
- Đáp án B loại vì chất xúc tác không ảnh hưởng đến chuyển dịch cân bằng.
- Đáp án C loại vì khi tăng áp suất cân bằng sẽ chuyển dịch theo chiều nghịch.
- Chọn đáp án D vì khi ta loại bỏ hơi nước, cân bằng sẽ chuyển dịch theo chiều tạo ra hơi nước hay cân bằng chuyển dịch theo chiều thuận.
Câu 17:
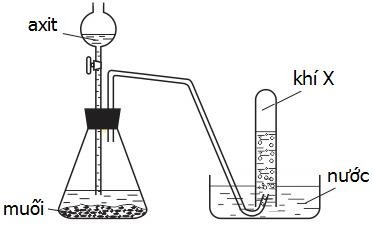
Sơ đồ trên không sử dụng để điều chế khí nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Khí HCl tan rất nhiều trong nước nên không thể điều chế bằng phương pháp đẩy nước.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Đáp án A loại vì O2không phản ứng với NaCl.
- Đáp án B loại vì O2không phản ứng với CaO.
- Đáp án D loại vì O2không phản ứng với Fe2O3.
Câu 19:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi cô cạn dung dịch thu được hỗn hợp muối khan tức 2 muối là Na2SO3 và NaHSO3
Gọi số mol của 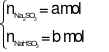


BTNT S ta có: 
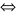 0,15 = a + b (1)
0,15 = a + b (1)
mmuối= 
 16,7 = 126a + 104b (2)
16,7 = 126a + 104b (2)
Từ (1) và (2) có hệ phương trình:

BTNT Na ta có:

 0,1 + 2.0,05 = 0,2 mol
0,1 + 2.0,05 = 0,2 mol
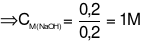
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Đáp án D sai vì: Fe3O4 tác dụng vớiH2SO4 đặctạo thành muối sắt (III) sunfat, SO2và H2O
2Fe3O4+ 10H2SO4 đặc→3Fe2(SO4)3+ SO2↑+ 10H2O
Câu 21:
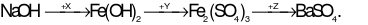
Các dung dịch X, Y, Z lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
2NaOH + FeCl2(X) →Fe(OH)2↓+ 2NaCl
2Fe(OH)2+ 4H2SO4(đặc, nóng) (Y) →Fe2(SO4)3+ SO2↑+ 6H2O
Fe2(SO4)3+ 3BaCl2(Z) →3BaSO4+ 2FeCl3
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nhìn vào 4 đáp án ta thấy khí Z có thể là (Cl2, HCl, SO2) nhưng
- Khí Z có màu vàng lục, mùi xốc  Khí Cl2( loại B và C)
Khí Cl2( loại B và C)
- Khi cho Na tác dụng với khí Z ( Khí Cl2)
2Na + Cl2→ 2NaCl  Chất X là NaCl
Chất X là NaCl
- X (NaCl) tác dụng với H2SO4đặc, đun nóng
NaCl + H2SO4 đặc NaHSO4+ HCl↑
NaHSO4+ HCl↑
⇒Khí Y là HCl. Khí HCl tan nhiều trong nước tạo ra dung dịch HCl (axit mạnh).
Khi cho HCl tác dụng với KMnO4.
16HCl + 2KMnO4→ 2KCl + 2MnCl2+ 8H2O + 5Cl2↑(Z)
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
TH1: X là Flo tức NaX là NaF → muối còn lại là NaCl → kết tủa là AgCl
NaCl + AgNO3→ AgCl + NaNO3
nNaCl = nAgCl = 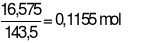
→ mNaCl = 6,75675 gam → mNaF= 1,31825 gam
→ %mNaF = 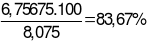
%mNaCl= 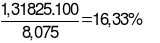
TH2: Cả hai muối đều tạo kết tủa.
Gọi công thức chung của 2 muối là 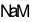
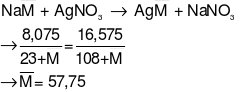
→ X là Clo, Y là Brom
Gọi số mol của hỗn hợp muối A là 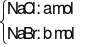
Theo bài ra ta có hệ phương trình:

Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
CO
SO2 (64)
57,32
6,68
13,32
CO2 (44)
SO2 (64)
57,32
6,68
13,32

Gọi
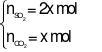
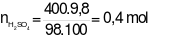
Ta có mhỗn hợp muối= 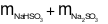
⇒31,4 = 104.2x + 106x ⇒ x = 0,1 mol
2NaHSO3+ H2SO4→ Na2SO4+ 2SO2+ H2O
0,2 0,1 0,1 0,2
Na2CO3+ H2SO4→ Na2SO4+ CO2+ H2O
0,1 0,1 0,1 0,1
Theo phương trình phản ứng ta có:
 phản ứng= 0,2 mol ⇒
phản ứng= 0,2 mol ⇒ dư= 0,4 – 0,2 = 0,2 mol
dư= 0,4 – 0,2 = 0,2 mol
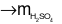 dư= 0,2.98 = 19,6 gam
dư= 0,2.98 = 19,6 gam
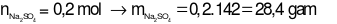
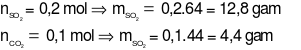
mdung dịch sau phản ứng = mhỗn hợp 2 muối +  ban đầu – (
ban đầu – (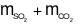 )
)
⇒mdung dịch sau phản ứng = 31,4 + 400 – (12,8 + 4,4) = 414,2 gam
Chất tan trong dung dịch sau phản ứng gồm: Na2SO4và H2SO4dư
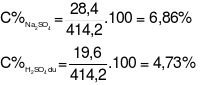
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Ta có: 
Giả sử kim loại M cũng tác dụng với dung dịch H2SO4loãng:
Fe + H2SO4 → FeSO4+ H2
M + H2SO4→ MSO4+ H2
→ nFe + nM= 0,2 mol
Gọi x và y lần lượt là số mol của Fe và M
→ x + y = 0,2
Nhìn vào các đáp án ta thấy các kim loại trên đều có hoá trị II
Tác dụng với H2SO4đặc, nóng dư:
2Fe + 6H2SO4 đặc, nóng → Fe2(SO4)3+ 3SO2+ 6H2O
M + 2H2SO4 đặc nóng→ MSO4+ SO2+ 2H2O

Áp dụng định luật bảo toàn electron ta có: 3x + 2y = 0,5
Theo bài ra ta có hệ phương trình:
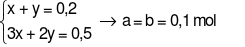
→ mFe= 0,1.56 =5,6 gam
→ mM= 12,1 – 5,6 = 6,5 gam
→ MM= 65 → Zn
II. PHẦN TỰ LUẬN: (2,5 điểm)
Câu 26:
(1 điểm)
Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện nếu có):NaCl Cl2
Cl2 CuCl2
CuCl2 BaCl2
BaCl2 AgCl.
AgCl.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
(1) 2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
(2) Cl2+ Cu  CuCl2
CuCl2
(3) CuCl2+ Ba(OH)2→ BaCl2+ Cu(OH)2↓
(4) BaCl2+ 2AgNO3→ 2AgCl↓ + Ba(NO3)2
Câu 27:
(1,5 điểm)
Hòa tan hoàn toàn 5,4 gam Al bằng dung dịch H2SO4đặc nóng, thu được V lít khí SO2 (sản phẩm khử duy nhất). Hấp thụ hoàn toàn V lít SO2bằng lượng dư dung dịch KOH, thu được dung dịch chứa m gam muối. Tính giá trị của m, V.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
Ta có: 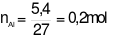
Phương trình phản ứng:
2Al + 6H2SO4 đặc, nóng→ Al2(SO4)3+ 3SO2+ 6H2O
0,2 → 0,3
 lít
lít
Vì dung dịch KOH dư nên tạo muối K2SO3