Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 9)
-
7190 lượt thi
-
27 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ở điều kiện thường: Cl2, O2ở thể khí, I2ở thể rắn, Br2ở thể lỏng.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Độ âm điện: F >Cl >Br >I.
Câu 3:
A. 5.
B. 2.
C. 7.
D. 3.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
Đáp án đúng là: C
Cấu hình e của nguyên tử Cl (Z = 17): [Ne]3s23p5.
→ Có 7e lớp ngoài cùng.
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết hoá học trong phân tử hiđro clorua (HCl) là liên kết cộng hóa trị có cực.
Câu 5:
A. NaCl.
B. NaClO.
C. CaCl2.
D. CaOCl2.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
Đáp án đúng là: D
Thành phần chính của clorua vôi là CaOCl2.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khi đun nóng, iot biến thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là sự thăng hoa.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
S phản ứng với kim loại Hg ngay ở nhiệt độ thường: Hg + S → HgS.
Câu 8:
Na2S2O3+ H2SO4→ Na2SO4+ S↓ + SO2+ H2O
Để tốc độ phản ứng trên xảy ra nhanh hơn, có thể thực hiện phương pháp nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
Câu 9:
Iot có tính oxi hóa yếu hơn brom vì iot có
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Iot có tính oxi hóa yếu hơn brom vì iot có bán kính lớn hơn, độ âm điện nhỏ hơn.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Có 3 chất phản ứng được với dung dịch HCl loãng là: AgNO3, KOH, FeS.
Phương trình hóa học:
AgNO3+ HCl → AgCl↓ + HNO3
KOH + HCl → KCl + H2O
FeS + 2HCl → FeCl2+ H2S↑
Câu 11:
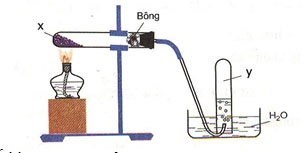
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hình vẽ trên mô tả thí nghiệm điều chế khí O2(Y) từ chất X là hợp chất giàu oxi và kém bền với nhiệt như: KMnO4, KClO3, …
Ví dụ: 2KMnO4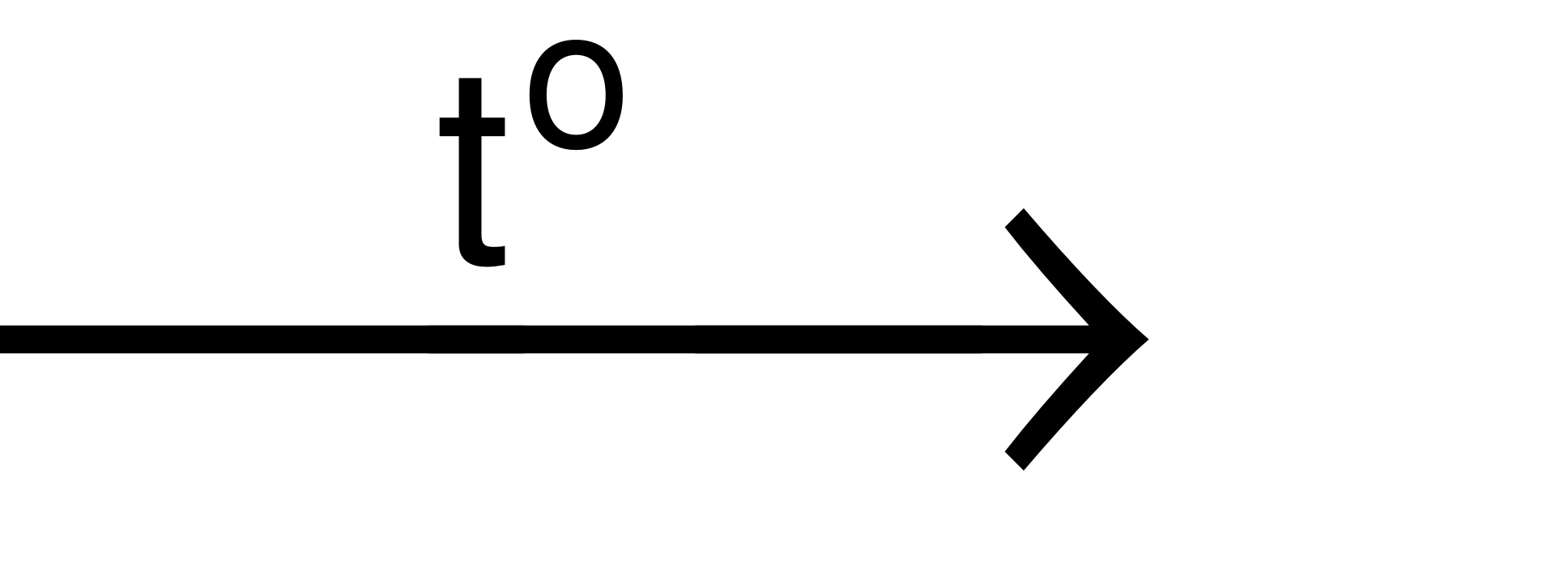 K2MnO4+ MnO2+ O2↑.
K2MnO4+ MnO2+ O2↑.
Khí O2tan ít trong nước → thu khí O2bằng cách đẩy nước.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dẫn khí H2S vào lượng dư dung dịch NaOH:
H2S + 2NaOH → Na2S + 2H2O.
→ Dung dịch thu được gồm: Na2S và NaOH dư.
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phương trình hóa học: Fe2O3+ 3H2SO4→ Fe2(SO4)3+ 3H2O.
→ Sản phẩm thu được: Fe2(SO4)3; H2O.
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phát biểu sai là: SO2là chất khí không màu, mùi trứng thối, nặng hơn không khí.
Sửa lại: SO2là chất khí không màu, mùi hắc, nặng hơn không khí (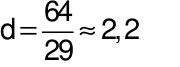 ).
).
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Hỗn hợp Mg và Al tác dụng với lượng dư dung dịch H2SO4:
Mg + H2SO4→ MgSO4+ H2↑
2Al + 3H2SO4→ Al2(SO4)3+ 3H2↑
→ Thu được 2 muối.
Loại B vì Cu không phản ứng, chỉ thu được 1 muối là MgSO4.
Loại C vì thu được 3 muối:
Fe3O4+ 4H2SO4→ Fe2(SO4)3+ FeSO4+ 4H2O
Zn + H2SO4→ ZnSO4+ H2↑
Loại D vì Ag không phản ứng với H2SO4loãng, chỉ có Fe2O3phản ứng thu được một muối là Fe2(SO4)3.
Câu 16:
Cho cân bằng hóa học: ![]() . Cân bằng trên không bị chuyển dịch khi
. Cân bằng trên không bị chuyển dịch khi
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
→ Số mol của hệ trước phản ứng = 1 + 1 = 2; số mol của hệ sau phản ứng = 2.
→ Cân bằng trên khôngbị chuyển dịch khi thay đổi áp suất chung của hệ.
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
nFe= 0,012 (mol).
Phương trình hóa học: 2Fe + 3Cl2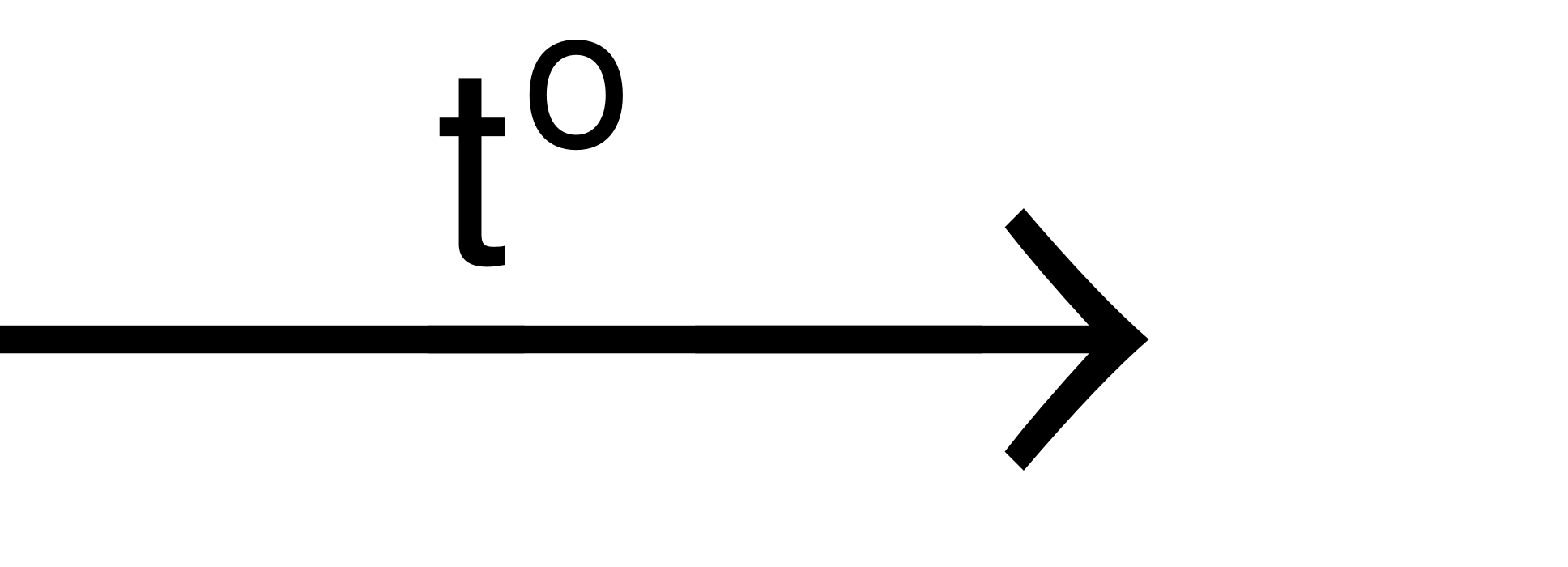 2FeCl3.
2FeCl3.
→ 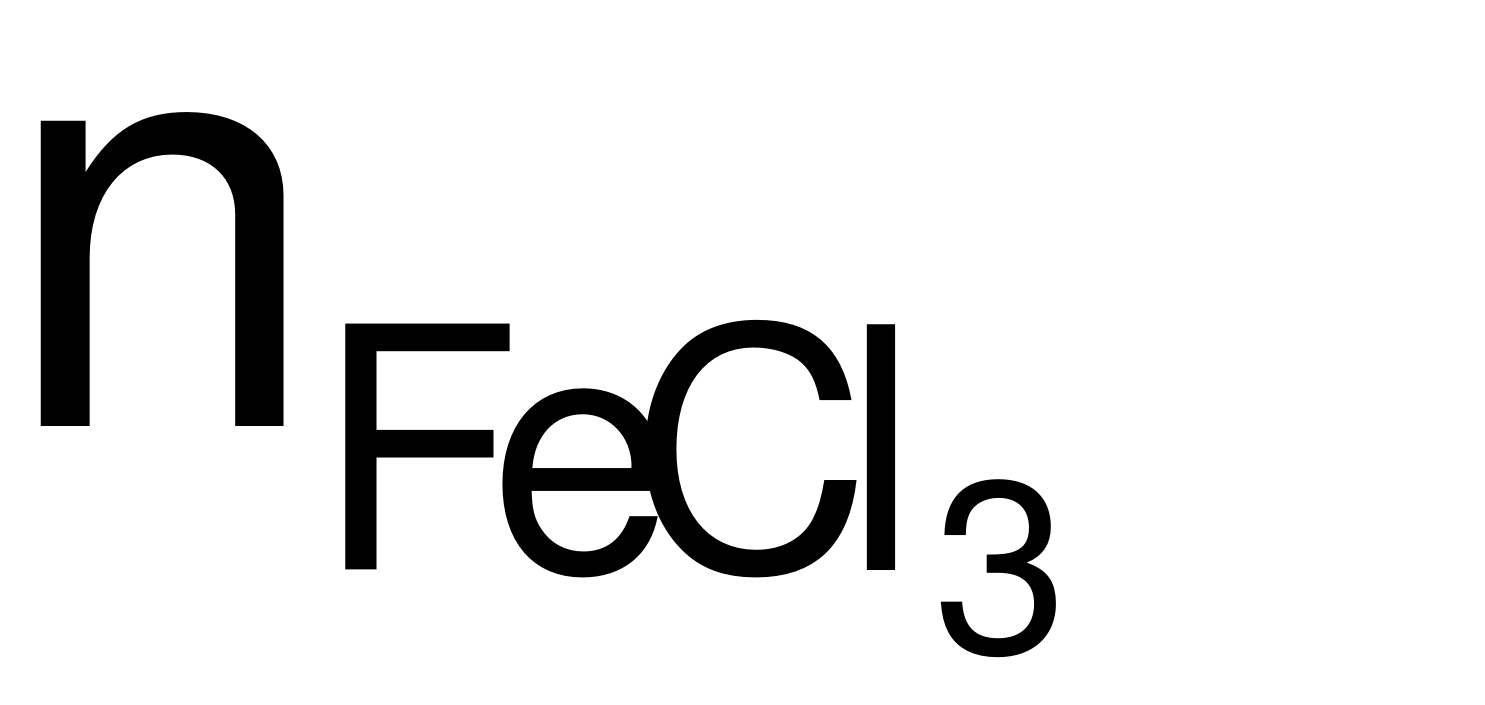 = nFe= 0,012 (mol)
= nFe= 0,012 (mol)
→ 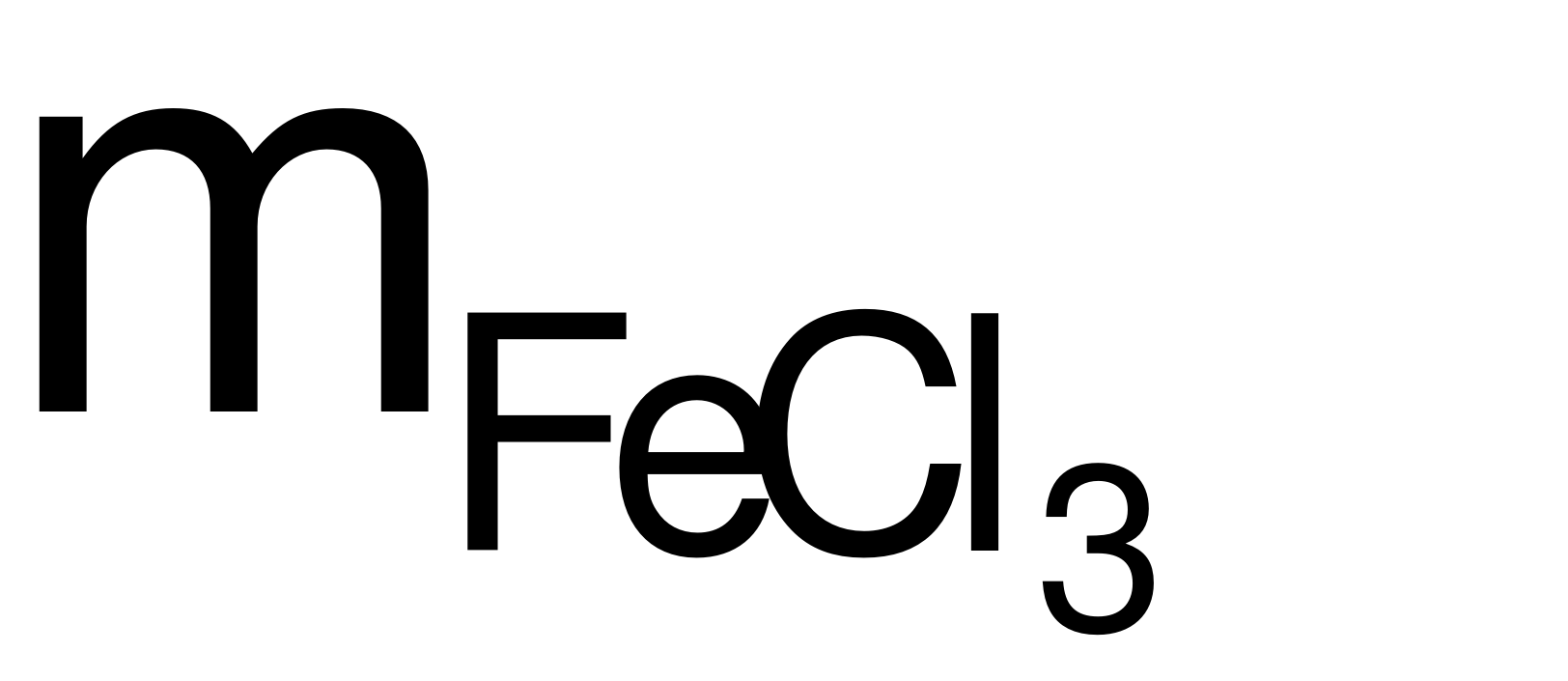 = 0,012×162,5 = 1,95 (gam).
= 0,012×162,5 = 1,95 (gam).
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
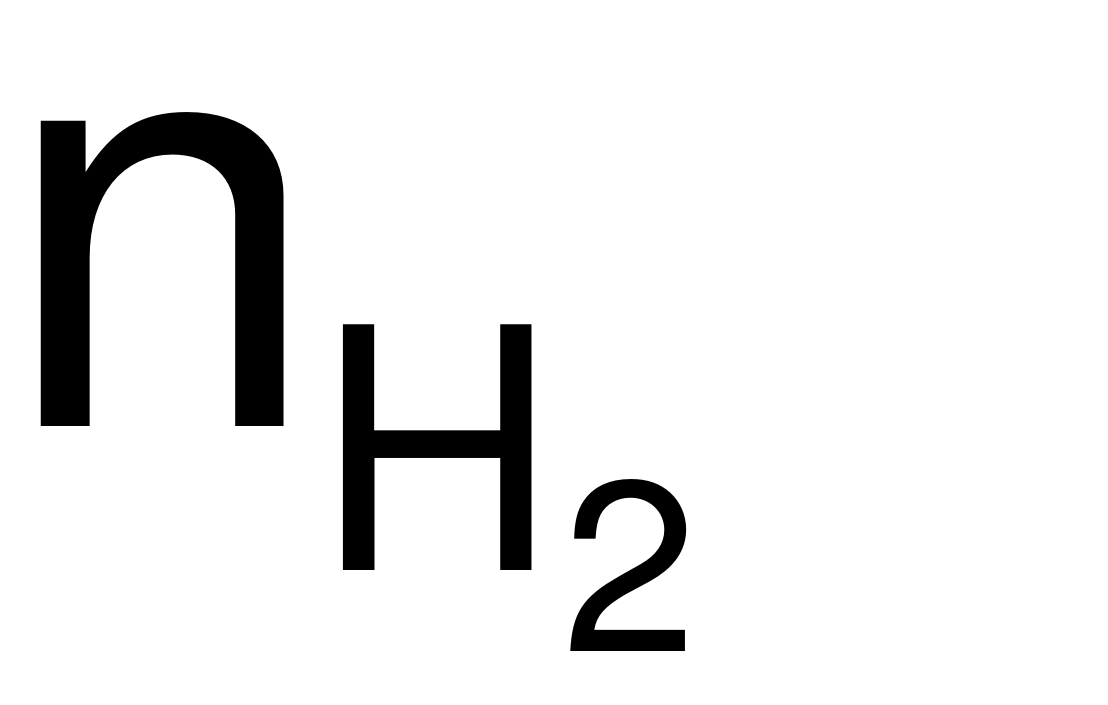 = 0,325 (mol) → nHCl= 2
= 0,325 (mol) → nHCl= 2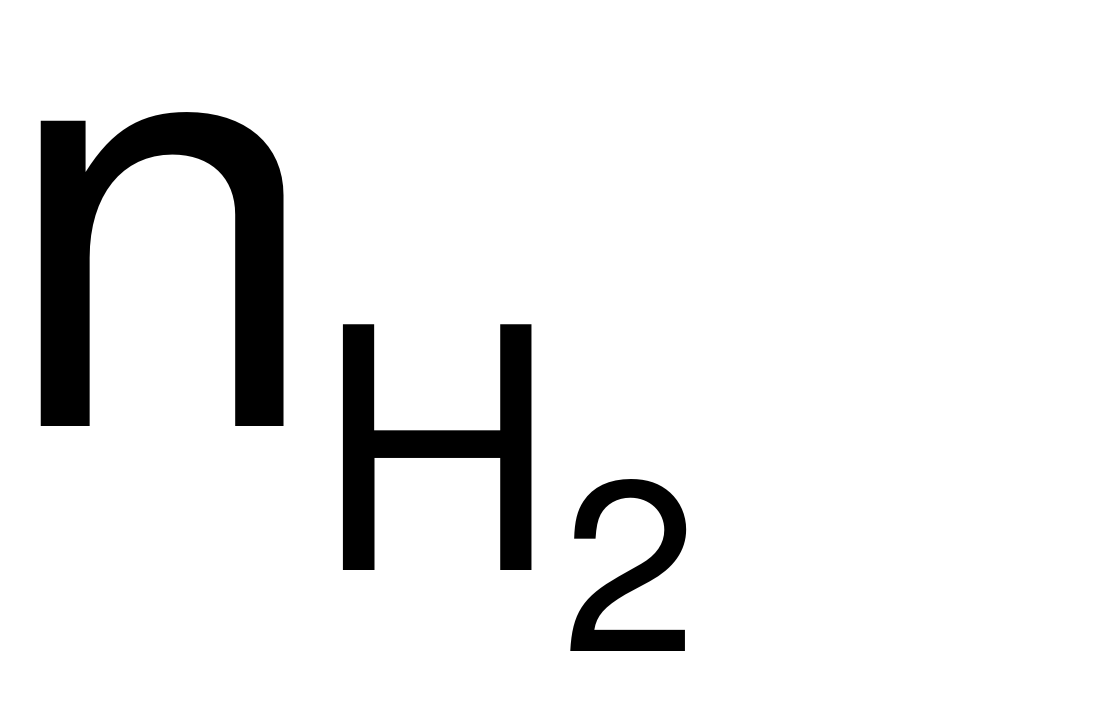 = 0,65 (mol).
= 0,65 (mol).
→ mMuối = m(Mg, Al) + m(Cl)= 6,45 + 0,65×35,5 = 29,525 (gam).
Câu 19:
(a) Dẫn khí Cl2vào dung dịch KI.
(b) Dẫn khí F2vào nước nóng.
(c) Cho Ag vào dung dịch HCl.
(d) Cho dung dịch HCl vào dung dịch Na2CO3.
(e) Cho dung dịch AgNO3vào dung dịch KF.
(g) Cho khí H2tác dụng với I2, có chiếu sáng.
Số thí nghiệm có xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Các thí nghiệm xảy ra phản ứng là: (a), (b), (d).
Phương trình hóa học:
(a) Cl2+ 2KI → 2KCl + I2
(b) 2F2+ 2H2O → 4HF + O2
(d) 2HCl + Na2CO3→ 2NaCl + CO2↑ + H2O
Chú ý: I2chỉ oxi hóa được H2ở nhiệt độ cao và có mặt chất xúc tác.
I2+ H2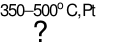 2HI
2HI
Câu 20:
Trong phương trình hóa học nào sau đây SO2thể hiện tính khử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
![]()
→ SO2thể hiện tính khử, Br2thể hiện tính oxi hóa.
![]()
→ SO2không thể hiện tính oxi hóa, không thể hiện tính khử.
![]()
→ SO2thể hiện tính oxi hóa, H2S thể hiện tính khử.
![]()
→ SO2không thể hiện tính oxi hóa, không thể hiện tính khử.
Câu 21:
Hoà tan hoàn toàn 6,48 gam kim loại R bằng dung dịch H2SO4loãng, thu được 6,048 lít khí H2 (đktc). Kim loại R là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
![]() (mol).
(mol).
Gọi hóa trị của kim loại R là n.
→ nR= ![]() (mol)
(mol)
→ MR= ![]() = 12n.
= 12n.
Chọn n = 2 → MR= 24 (đvC) → R là kim loại Magie (Mg).
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phát biểu đúng: Có thể phân biệt hai dung dịch NaCl và H2SO4bằng BaCl2(thấy xuất hiện kết tủa trắng là H2SO4, không có hiện tượng gì là NaCl).
Loại B vì: Ở nhiệt độ thường, oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, …).
Loại C vì: Đốt cháy FeS trong lượng dư khí oxi thì thu được Fe2O3và SO2.
4FeS + 7O2→ 2Fe2O3+ 4SO2
Loại D vì: Dung dịch H2SO4 loãng không hòa tan được cacbon và lưu huỳnh (chú ý: Dung dịch H2SO4 đặc, nóng hòa tan được cacbon và lưu huỳnh)
Câu 23:
Sau khi phản ứng xảy ra hoàn toàn, thí nghiệm nào sau đây thu được số mol khí lớn nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
2KMnO4+ 16HCl → 2KCl + 2MnCl2+ 5Cl2+ 8H2O
12,5(mol)→ ![]() = 2,5 (mol).
= 2,5 (mol).
CaCO3+ 2HCl → CaCl2+ CO2↑ + H2O
1 1(mol) → ![]() = 1 (mol).
= 1 (mol).
2KMnO4![]() K2MnO4+ MnO2+ O2↑
K2MnO4+ MnO2+ O2↑
10,5 (mol) → ![]() = 0,5 (mol).
= 0,5 (mol).
2Al + 3H2SO4→ Al2(SO4)3+ 3H2↑
1 1,5 (mol) → ![]() = 1,5 (mol).
= 1,5 (mol).
→ Thí nghiệm thu được số mol khí lớn nhất: Cho 1 molKMnO4 tác dụng với lượng dư dung dịch HCl đặc.
Câu 24:
Đốt cháy hoàn toàn m gam hỗn hợp X gồm Cu, Mg và Al cần vừa đủ a mol khí oxi, thu được1,71 gam chất rắn Y. Hòa tan hoàn toàn 0,855 gam Y bằng lượng vừa đủ dung dịch H2SO4loãng, thu được dung dịch Z. Cô cạn Z, thu được 2,255 gam muối khan. Tổng giá trị của m và a có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Bảo toàn khối lượng: mX+ ![]() = mY→ m + 32a = 1,71 (1).
= mY→ m + 32a = 1,71 (1).
Trong 0,855 gam Y có:
![]() (mol), m(Cu, Mg, Al)=
(mol), m(Cu, Mg, Al)= ![]() (gam).
(gam).
Cho Y tác dụng với dung dịch H2SO4(2H + O → H2O).
→ 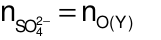 = a (mol).
= a (mol).
→ mmuối= m(Cu, Mg, Al) + ![]() → 0,5m + 96a = 2,255 (2)
→ 0,5m + 96a = 2,255 (2)
Từ (1) và (2), suy ra: m = 1,15; a = 0,0175.
→ m + a = 1,15 + 0,0175 = 1,1675 ≈ 1,2.
Câu 25:
Đốt cháy m gam hỗn hợp X gồm Fe và Cu trong không khí, sau một thời gian thu được 1,22 gam chất rắn Y. Hòa tan hoàn toàn Y bằng lượng dư dung dịch H2SO4đặc, đun nóng thì thu được 252 ml (đktc) khí SO2(sản phẩm khử duy nhất) và dung dịch chứa 3,3 gam hỗn hợp muối sunfat. Phần trăm khối lượng của Cu có trong X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Coi chất rắn Y gồm: Fe (x mol), Cu (y mol) và O (z mol).
→ 56x + 64y + 16z = 1,22 (1)
mmuối= ![]() = 400×0,5x + 160y = 3,3 (2)
= 400×0,5x + 160y = 3,3 (2)
![]() (mol).
(mol).
Bảo toàn electron: 3nFe+ 2nCu= 2![]() + 2nO(Y)
+ 2nO(Y)
→ 3x + 2y = 2×0,01125 + 2z (3)
Từ (1), (2) và (3), suy ra: x = 0,0125; y = 0,005; z = 0,0125.
→%mCu= ![]() .
.
Câu 26:
Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện phản ứng, nếu có):
MnO2![]() Cl2
Cl2![]() NaCl
NaCl ![]() HCl
HCl ![]() FeCl2
FeCl2
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
(1) MnO2+ 4HCl(đặc)![]() MnCl2+ Cl2↑ + 2H2O
MnCl2+ Cl2↑ + 2H2O
(2) Cl2+ 2Na→ 2NaCl
(3) NaCl(rắn)+ H2SO4 (đặc)![]() NaHSO4+ HCl
NaHSO4+ HCl
(4) 2HCl + Fe → FeCl2+ H2↑
Câu 27:
(1,5 điểm) Hòa tan hoàn toàn 4,42 gam hỗn hợp X gồm Fe và Al bằng dung dịch H2SO4loãng, thu được dung dịch Y và 3,136 lít khí H2(đktc). Xác định phần trăm khối lượng mỗi kim loại trong X.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
![]() = 0,14 (mol).
= 0,14 (mol).
Gọi số mol của Fe và Al trong hỗn hợp X lần lượt là x, y (mol).
→ 56x + 27y = 4,42 (1)
Bảo toàn electron: 2nFe+ 3nAl= 2![]()
→ 2x + 3y = 0,28 (2)
Từ (1) và (2), suy ra: x = 0,05; y = 0,06.
%mFe= 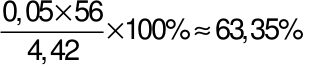 ;
;
%mAl= 100% - 63,35% = 36,65%.
