Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 19)
-
7185 lượt thi
-
14 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
(2,5 điểm).
Viết các phương trình phản ứng hóa học xảy ra theo sơ đồ sau (ghi rõ điều kiện):FeS2  SO2
SO2 SO3
SO3 H2SO4
H2SO4  CuSO4
CuSO4 BaSO4
BaSO4
 Xem đáp án
Xem đáp án
Hướng dẫn giải
(1) 4FeS2+ 11O2 2Fe2O3+ 8SO2
2Fe2O3+ 8SO2
(2) 2SO2+ O2 2SO3
2SO3
(3) SO3+ H2O → H2SO4
(4) H2SO4+ CuO → CuSO4+ H2O
(5) CuSO4+ BaCl2→ BaSO4↓ + CuCl2
Câu 2:
(2,5 điểm).
Cho 3,84 gam hỗn hợp A gồm Mg và FeO tác dụng với dung dịch HCl 0,25M thu được 2,24 lit khí ở đktc.
a, Tính phần trăm khối lượng mỗi chất trong hỗn hợp A.
b, Tính thể tích dung dịch axit HCl đã dùng.
c, Mặt khác, cho hỗn hợp A tác dụng với dung dịch H2SO4đặc nóng dư, thu được V lit hỗn hợp khí Y gồm SO2và H2S( ở đktc). Biết tỉ khối của Y so với H2bằng 26. Tính giá trị của V
 Xem đáp án
Xem đáp án
Hướng dẫn giải
a, Phương trình phản ứng:
Mg + 2HCl → MgCl2+ H2
FeO + 2HCl → FeCl2+ H2O
Số mol khí H2thu được là: 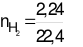 = 0,1 mol
= 0,1 mol
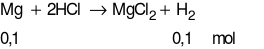
Theo phương trình phản ứng ta có: nMg= 0,1 mol suy mMg= 0,1.24 = 2,4 gam.
Vậy %mMg= 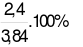 = 62,5%
= 62,5%
%mFeO= 100% - 62,5% = 37,5%
b, Khối lượng của FeO là: mFeO= 3,84 – 2,4 = 1,44 gam
⇒ nFeO= 0,02 mol
Phương trình phản ứng:
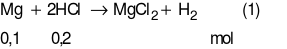
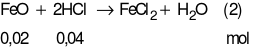
Từ phương trình phản ứng (1) và (2) suy ra nHCl= 0,2 + 0,04 = 0,24 mol
Vậy thể tích dung dịch axit HCl đã dùng là: VHCl= 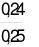 = 0,96 lít
= 0,96 lít
c,
Tỉ khối của Y so với H2bằng 26 suy ra 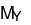 = 52, ta có:
= 52, ta có:
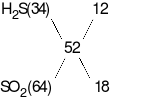
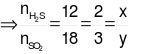
Mặt khác, bảo toàn mol electron ta có: 8x + 2y = 2nMg + nFeO= 0,22
Suy ra x = 0,02 mol; y = 0,03 mol
Vậy V = 22,4.(0,02+0,03) = 1,12 lit
(Họcsinhkhôngđượcsửdụngbảnghệthốngtuầnhoàncácnguyêntốhóahọc)
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Axit sunfuric đặc làm khô chất: SO2vì H2SO4hút ẩm và SO2không phản ứng với H2SO4đặc.
Câu 4:
A.11,6 gam.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số mol SO2là: 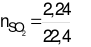 = 0,1 mol
= 0,1 mol
Sục khí SO2vào dung dịch NaOH dư tạo ra muối trung hòa Na2SO3.
Phương trình phản ứng:

Khối lượng muối thu được là:  = 0,1.126 = 12,6 gam.
= 0,1.126 = 12,6 gam.
Câu 5:
C.Mg, NaOH, CuO.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Mg + 2HCl → MgCl2+ H2
NaOH + HCl → NaCl + H2O
CuO + 2HCl → CuCl2+ H2O
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B.
Số oxi hóa của S trong các chất K2SO3, SO2, H2S lần lượt là: +4; +4; -2.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
KClO3+ 6HCl → KCl + 3Cl2+ 3H2O
Tổng hệ số của các chất sản phẩm sau khi cân bằng là: 1 + 3 + 3 = 7
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số mol khí O2là: 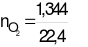 = 0,06 mol
= 0,06 mol
Phương trình phản ứng:

Vậy khối lượng KClO3là: m = 0,04.122,5 = 4,9 gam
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tính axit giảm dần theo thứ tự: HI >HBr >HCl >HF.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Oxi không phản ứng trực tiếp với: Brom.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số mol khí H2là: 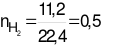 mol suy ra ne nhận = 0,5.2 = 1 mol
mol suy ra ne nhận = 0,5.2 = 1 mol
Mg → Mg+2 + 2e, Al → Al+3+ 3e, Fe → Fe+3+ 3e
2H++ 2e → H2
Bảo toàn e ta có: ne(KL nhường) =  (nhận) = 1 mol
(nhận) = 1 mol
Lại có: moxit= mKL+ mO
Bảo toàn e ta có: ne(KL nhường) = nOxi(nhận) = 1 mol
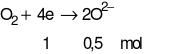
Suy ra nO = 0,5 mol suy ra mO= 0,5.16 = 8 gam
Vậy khối lượng oxit thu được là: moxit= mKL+ mO = 13,4 + 8 = 21,4 gam
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Có ∆H = -58KJ < 0 suy ra khi giảm nhiệt độ cân bằng sẽ chuyển dịch theo chiều thuận.
PHẦN II. TỰ LUẬN (5 Điểm)
Câu 13:
(2,5 điểm).
Viết các phương trình phản ứng hóa học xảy ra theo sơ đồ sau (ghi rõ điều kiện):FeS2  SO2
SO2 SO3
SO3 H2SO4
H2SO4  CuSO4
CuSO4 BaSO4
BaSO4
 Xem đáp án
Xem đáp án
Hướng dẫn giải
(1) 4FeS2+ 11O2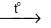 2Fe2O3+ 8SO2
2Fe2O3+ 8SO2
(2) 2SO2+ O2 2SO3
2SO3
(3) SO3+ H2O → H2SO4
(4) H2SO4+ CuO → CuSO4+ H2O
(5) CuSO4+ BaCl2→ BaSO4↓ + CuCl2
Câu 14:
(2,5 điểm).
Cho 3,84 gam hỗn hợp A gồm Mg và FeO tác dụng với dung dịch HCl 0,25M thu được 2,24 lit khí ở đktc.
a, Tính phần trăm khối lượng mỗi chất trong hỗn hợp A.
b, Tính thể tích dung dịch axit HCl đã dùng.
c, Mặt khác, cho hỗn hợp A tác dụng với dung dịch H2SO4đặc nóng dư, thu được V lit hỗn hợp khí Y gồm SO2và H2S( ở đktc). Biết tỉ khối của Y so với H2bằng 26. Tính giá trị của V
 Xem đáp án
Xem đáp án
Hướng dẫn giải
a, Phương trình phản ứng:
Mg + 2HCl → MgCl2+ H2
FeO + 2HCl → FeCl2+ H2O
Số mol khí H2thu được là: 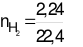 = 0,1 mol
= 0,1 mol
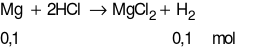
Theo phương trình phản ứng ta có: nMg= 0,1 mol suy mMg= 0,1.24 = 2,4 gam.
Vậy %mMg= 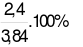 = 62,5%
= 62,5%
%mFeO= 100% - 62,5% = 37,5%
b, Khối lượng của FeO là: mFeO= 3,84 – 2,4 = 1,44 gam
⇒ nFeO= 0,02 mol
Phương trình phản ứng:
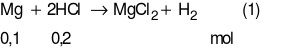
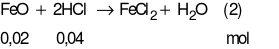
Từ phương trình phản ứng (1) và (2) suy ra nHCl= 0,2 + 0,04 = 0,24 mol
Vậy thể tích dung dịch axit HCl đã dùng là: VHCl= 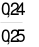 = 0,96 lít
= 0,96 lít
c,
Tỉ khối của Y so với H2bằng 26 suy ra 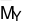 = 52, ta có:
= 52, ta có:
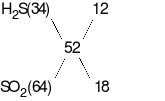
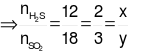
Mặt khác, bảo toàn mol electron ta có: 8x + 2y = 2nMg + nFeO = 0,22
Suy ra x = 0,02 mol; y = 0,03 mol
Vậy V = 22,4.(0,02+0,03) = 1,12 lit
(Học sinh không được sử dụng bảng hệ thống tuần hoàn các nguyên tố hóa học)
