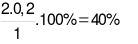Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 16)
-
7188 lượt thi
-
11 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Dung dịch nào sau đây khôngthể chứa trong bình thủy tinh?
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Dung dịch không thể chứa trong bình thủy tinh: HF.
Vì SiO2+ 4HF → SiF4+ 2H2O
Do đó HF được dùng để khắc chữ lên thủy tinh.
Câu 2:
Nguyên tố nào sau đây trong tất cả các hợp chất chỉ có số oxi hóa -1?
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Trong tất cả các hợp chất nguyên tố chỉ có số oxi hóa -1 là: Flo.
Câu 3:
Nước Gia-ven là hỗn hợp các chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Nước Gia-ven là hỗn hợp các chất: NaCl, NaClO, H2O.
Câu 4:
Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm oxi là
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm oxi là ns2np4.
Câu 5:
Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
 K2MnO4+ MnO2+ O2
K2MnO4+ MnO2+ O2
Câu 6:
Phản ứng hòa tan đá CaCO3bằng dung dịch HCl có tốc độ lớn nhất trong thí nghiệm nào
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Phản ứng hòa tan đá CaCO3bằng dung dịch HCl có tốc độ lớn nhất trong thí nghiệm: Nghiền nhỏ đá vôi và dùng dung dịch HCl 2M.
Câu 7:
Cho cân bằng:C(r)+ CO2 (k)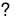 2CO(k),
2CO(k),  >0
>0
Khi thêm vào hệ một lượng khí CO2: cân bằng chuyển dịch theo chiều ..........
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
C(r)+ CO2 (k)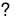 2CO(k),
2CO(k), 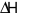 >0
>0
Khi thêm vào hệ một lượng khí CO2: cân bằng chuyển dịch theo chiều thuận (chiều làm giảm CO2).
Câu 8:
Có 4 lọ, mỗi lọ đựng một dung dịch không màu: NaCl, HCl, Na2SO4, NaNO3. Hãy phân biệt dung dịch đựng trong mỗi lọ bằng phương pháp hóa học.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho quỳ tím vào các mẫu thử, nếu:
+ Qùy tím chuyển sang đỏ thì là HCl
+ Không đổi màu là: NaCl, Na2SO4, NaNO3
- Cho BaCl2vào các mẫu thử còn lại:
+ Mẫu thử xuất hiện kết tủa trắng là Na2SO4
Phương trình phản ứng: BaCl2+ Na2SO4→ BaSO4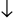 + 2HCl
+ 2HCl
+ Còn lại là NaCl, NaNO3
- Cho AgNO3vào hai mẫu thử còn lại:
+ Mẫu thử xuất hiện kết tủa trắng là NaCl
+ Còn lại là dung dịch NaNO3
Phương trình phản ứng:
AgNO3+ NaCl → AgCl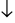 + NaNO3
+ NaNO3
Câu 9:
Hoàn thành chuỗi phản ứng:
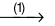 Cl2
Cl2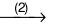 HCl
HCl 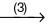 CuCl2
CuCl2 Cu(OH)2
Cu(OH)2
 Xem đáp án
Xem đáp án
Hướng dẫn giải
(1) MnO2+ 4HCl  MnCl2+ Cl2+ 2H2O
MnCl2+ Cl2+ 2H2O
(2) Cl2+ H2  2HCl
2HCl
(3) 2HCl + CuO → CuCl2+ H2O
(4) CuCl2+ 2NaOH → Cu(OH)2↓ + 2NaCl
Câu 10:
Dẫn 5,6 lít (đktc) khí H2S lội chậm qua bình đựng 350 ml dung dịch NaOH 1M. Tính khối lượng muối thu được?
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
Số mol H2S là: 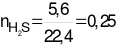 mol
mol
Số mol NaOH là: nNaOH= 0,35.1 = 0,35 mol
Xét: 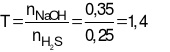

Sau phản ứng thu được 2 muối NaHS và Na2S
Gọi x, y lần lượt là số mol NaHS và Na2S ta có:
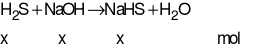
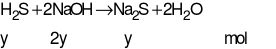
Có hệ phương trình:

Giải hệ phương trình được: x = 0,15, y = 0,1
Vậy mNaHS= 0,15.56 = 8,4 gam, 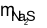 = 0,1.78 = 7,8 gam
= 0,1.78 = 7,8 gam
mmuối= 8,4 + 7,8 = 16,2 gam.
Câu 11:
Bình kín dung tích không đổi chứa đầy hỗn hợp X gồm H2S và oxi (dư) có tỉ khối so với H2 bằng ![]() Đốt cháy hỗn hợp X thu được hỗn hợp Y gồm khí và hơi có tỉ khối so với H2 bằng 17,5. Hiệu suất phản ứng oxi hóa H2S là?
Đốt cháy hỗn hợp X thu được hỗn hợp Y gồm khí và hơi có tỉ khối so với H2 bằng 17,5. Hiệu suất phản ứng oxi hóa H2S là?
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
Khối lượng mol trung bình của X và Y lần lượt là  và 35
và 35
Sử dụng sơ đồ đường chéo cho khối lượng mol trung bình của hỗn hợp X, ta có: 
Chọn số mol của H2S và O2trong X lần lượt là 1 mol và 2 mol và gọi số mol H2S phản ứng là 2x mol
Phản ứng:
2H2S + 3O2→ 2SO2+ 2H2O
Ban đầu: 12 mol
Phản ứng: 2x3x2x2x mol
Kết thúc: (1-2x)(2-3x)2x2xmol
Có mX= mY⇒ 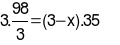 ⇒ x = 0,2 mol
⇒ x = 0,2 mol
Vậy H =