Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 15)
-
7181 lượt thi
-
22 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Trích các mẫu thử
- Cho dung dịch AgNO3vào các mẫu thử:
+ Xuất hiện kết tủa trắng thì đó là NaCl và BaCl2(1)
Phương trình hóa học:
NaCl + AgNO3→ NaNO3+ AgCl↓
BaCl2+ 2AgNO3→ Ba(NO3)2+ 2AgCl↓
+ Không hiện tượng là NaNO3và Ba(NO3)2(2)
- Cho dung dịch H2SO4vào nhóm (1)
+ Không có hiện tượng là NaCl
+ Xuất hiện kết tủa trắng thì đó là BaCl2
Phương trình hóa học: BaCl2+ H2SO4→ BaSO4↓ + 2HCl
- Cho dung dịch H2SO4vào nhóm (2)
+ Không hiện tượng là NaNO3
+ Xuất hiện kết tủa trắng là Ba(NO3)2
Phương trình hóa học: Ba(NO3)2+ H2SO4→ BaSO4↓ + 2HNO3
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dãy gồm các kim loại không tác dụng với H2SO4đặc, nguội là: Fe, Al.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khi đặt hai bình mở nút đựng dung dịch HCl đặc và dung dịch NH3ở gần nhau thì thấy có “khói” màu trắng. Do HCl và NH3là những hợp chất dễ bay hơi nên hơi của chúng đã hóa hợp với nhau tạo thành tinh thể muối amoni clorua, chính tinh thể này đã tạo nên hiện tượng “khói”.
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là:D
Trong phòng thí nghiệm, để điều chế khí clo người ta oxi hóa HCl.
2Cl-→ Cl2+ 2e
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Để điều chế Cl2không thể dùng phản ứng: HCl đặc + SO3.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
Ta có: mmuối= mkim loại+  (trong muối)
(trong muối)
 (trong muối) =
(trong muối) = 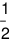 .(6nS+ 8
.(6nS+ 8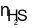 ).96 = 48.(6.0,2 + 8.0,2) = 134,4 gam
).96 = 48.(6.0,2 + 8.0,2) = 134,4 gam
Vậy mmuối= 1,4.24 + 134,4 = 168 gam.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Trong nhóm halogen, từ flo đến iot, phản ứng với H2yếu dẫn:
F2+ H2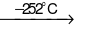 2HF
2HF
Cl2+ H2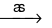 2HCl
2HCl
Br2+ H2 2HBr
2HBr
I2+ H2 2HI
2HI
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Mệnh đề sai khi so sánh khí cacbonic với khí sunfurơ: CO2 và SO2đều làm mất màu dung dịch Br2.
Vì chỉ SO2làm mất màu nước brom
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Để pha loãng H2SO4đặc an toàn phải cho từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh. Tuyệt đối không làm ngược lại do nước sẽ sôi đột ngột kéo theo những giọt axit bắn ra ngoài gây nguy hiểm.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
2Al + 4H2SO4 (đặc/ nóng)→ Al2(SO4)3+ S + 4H2O
Lúc cân bằng (hệ số là số nguyên tối giản), trong phản ứng Al tác dụng với H2SO4đặc, nóng tạo ra lưu huỳnh, số phân tử H2SO4đóng vai trò chất oxi hóa là 1.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D.
Liên kết hoá học trong phân tử F2, Cl2, Br2, I2, O2đều là liên kếtcộng hoá trị không cực.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B.
Để khắc chữ lên thuỷ tinh người ta thường dùng chất: HF.
Dung dịch HF có khả năng ăn mòn thủy tinh, theo phản ứng:
4HF + SiO2→ SiF4+ 2H2O
Câu 13:
CO2có lẫn tạp chất SO2, dùng cách nào dưới đây để thu được CO2nguyên chất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
CO2có lẫn tạp chất SO2, để thu được CO2nguyên chất người ta dùng cách sục hỗp hợp khí qua dung dịch thuốc tím dư. Khi đó, SO2phản ứng bị giữ lại trong dung dịch; CO2không phản ứng, thoát ra được CO2tinh khiết.
5 + 2KMnO4+ 2H2O → K2SO4+ 2MnSO4+ 2H2SO4
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Sử dụng dung dịch FeCl3, chỉ có Fe và Cu tan.
Fe + 2FeCl3→ 3FeCl2
Cu + 2FeCl3→ CuCl2+ 2FeCl2
Lọc thu được Ag, khối lượng không thay đổi so với ban đầu.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Thành phần của nước clo gồmHClO, HCl, Cl2, H2O.
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Quy 2 kim loại kiềm cần tìm về 1 kim loại R
Có: 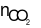 = 0,2 (mol)
= 0,2 (mol)
Phương trình phản ứng:

Có: mHCl= 0,4.36,5 = 14,6 gam,
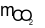 = 0,2.44 = 8,8 gam,
= 0,2.44 = 8,8 gam,
 = 0,2.18 = 3,6 gam
= 0,2.18 = 3,6 gam
Áp dụng định luật bảo toàn khối lượng suy ra:
mmuối= 24,4 + 14,6 – 8,8 – 3,6 = 26,6 g.
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số mol H2là: 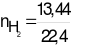 = 0,6 mol ⇒
= 0,6 mol ⇒ 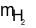 = 1,2 gam.
= 1,2 gam.
Có  = 0,6 mol, bảo toàn nguyên tố H ⇒
= 0,6 mol, bảo toàn nguyên tố H ⇒ 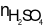 = 0,6 mol
= 0,6 mol
⇒ 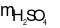 = 98.0,6 = 58,8 gam
= 98.0,6 = 58,8 gam
Áp dụng định luật bảo toàn khối lượng ta có:
mKL+ 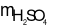 = mmuối+
= mmuối+ 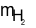
Suy ra mmuối= 29 + 58,8 – 1,2 = 86,6 gam.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cu + 2H2SO4 đặc/ nóng→ CuSO4+ SO2↑ + 2H2O
Na2SO3+ H2SO4→ Na2SO4+ SO2↑ + H2O
S + 2H2SO4→ 3SO2↑ + 2H2O
2Al + 6H2SO4 đặc/ nóng→ Al2(SO4)3+ 3SO2↑ + 6H2O
Dựa vào các phản ứng hóa học xác định được, với các chất: Cu; Na2SO3; S; Al có cùng số mol; cho S tác dụng với H2SO4thu được nhiều SO2nhất.
Câu 19:
Cho 45g hỗn hợp Zn và Cu tác dụng vừa đủ dung dịch H2SO498% nóng thu được dung dịch X và khí Y. Cô cạn dung dịch X thu được 112,2 gam hỗn hợp muối khan. Dẫn toàn bộ khí Y vào 500ml dung dịch NaOH 2M. Khối lượng muối tạo thành là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
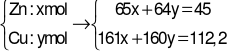
Giải hệ phương trình được: x = 0,2; y = 0,5
Bảo toàn e có: 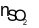 = nZn+ nCu= 0,7 mol
= nZn+ nCu= 0,7 mol
Đặt 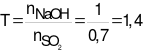
Vậy sau phản ứng thu đươc 2 muối: Na2SO3(a mol) và NaHSO3(b mol)
Bảo toàn nguyên tố Na: 2a + b = 1
Bảo toàn nguyên tố S: a + b = 0,7
Suy ra a = 0,3, b = 0,4
Vậy  = 0,3.126 = 37,8 g,
= 0,3.126 = 37,8 g, 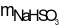 = 0,4.104 = 41,6 g.
= 0,4.104 = 41,6 g.
Câu 20:
(1 điểm).
Viết phương trình phản ứng chứng minh: Xem đáp án
Xem đáp án
Các phản ứng chứng minh:
a. SO2+ 2H2S → 3S + 2H2O
Số oxi hóa của S giảm từ +4 xuống 0, vậy SO2có tính oxi hóa.
b. S + O2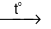 SO2
SO2
Số oxi hóa của S tăng từ 0 lên +4, vậy S có tính khử.
Câu 21:
(1,5 điểm).
Cho cân bằng hoá học sau:2NO2 (k) 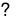 N2O4 (k)
N2O4 (k)
Màu nâu đỏ Không màu
Biết rằng khi cho bình phản ứng ở nhiệt độ phòng vào chậu nước đá, màu nâu của bình nhạt dần.
Tăng dung tích bình phản ứng.
Tăng nhiệt độ của hệ.
 Xem đáp án
Xem đáp án
a. Khi cho bình phản ứng vào chậu nước đá tức giảm nhiệt độ của hệ thì màu nâu của bình nhạt dần chứng tỏ giảm nhiệt độ cân bằng chuyển dịch theo chiều thuận. Mà giảm nhiệt độ hệ phản ứng thì cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt nên chiều thuận của phản ứng là phản ứng tỏa nhiệt.
b. Tăng dung tích bình phản ứng thì áp suất của hệ phản ứng tăng thì cân bằng sẽ chuyển dịch theo chiều làm giảm số mol khí, tức chiều thuận.
Tăng nhiệt độ của hệ phản ứng thì cân bằng sẽ chuyển dịch theo chiều phản ứng thu nhiệt, tức chiều nghịch.
Câu 22:
Cho 16 gam hỗn hợp Fe và Mg tác dụng vừa đủ với 400ml dung dịch H2SO4 loãng thì thu được 8,96 lít khí (đktc).
 Xem đáp án
Xem đáp án
a) Đặt số mol của Fe và Mg lần lượt là x và y mol
Suy ra 56x + 24y = 16 (1)
Phương trình hóa học:
Fe + H2SO4(loãng) → FeSO4+H2
Mg + H2SO4(loãng) → MgSO4+ H2
Suy ra nkhí= x + y = 0,4 (2)
Từ (1) và (2) có: x = y = 0,2
Suy ra mFe= 11,2 gam; mMg= 4,8 gam.
Có naxit= nkhí= 0,4 mol ⇒ CM(axit) = 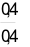 = 1M.
= 1M.
b) Cho hỗn hợp trên tác dụng với H2SO4đặc, nguội thì chỉ có Mg phản ứng.
Trong 8g hỗn hợp có 0,1 mol Mg
Bảo toàn e có 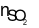 = nMg= 0,1 mol
= nMg= 0,1 mol
Vậy Vkhí= 2,24 lít.
