Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 14)
-
7175 lượt thi
-
29 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dùng hồ tinh bột có thể nhận biết được chất: I2.
Hiện tượng: Xuất hiện màu xanh tím đặc trưng.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
nZn= 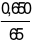 = 0,01 mol, nS=
= 0,01 mol, nS= 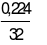 = 0,007 mol
= 0,007 mol
Phương trình phản ứng: Zn + S  ZnS
ZnS 
Xét:  suy ra Zn dư, S phản ứng hết
suy ra Zn dư, S phản ứng hết
Vậy mZnS= 0,007.97 = 0,679 gam
Câu 3:
Phần 1: Cho tác dụng với dung dịch H2SO4loãng, dư thì thu được 4,48 lít khí (đktc).
Phần 2: Cho tác dụng với H2SO4đặc, nóng dư thì sau phản ứng hoàn toàn thu được 5,6 lít khí SO2(ở đktc, sản phẩm khử duy nhất).
Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Gọi số mol Fe và Mg ở mỗi phần lần lượt là x và y (mol)
Phần 1: Bảo toàn electron có:
2x + 2y = 2nkhí= 0,4 (1)
Phần 2: Bảo toàn electron có:
3x + 2y = 2nkhí= 0,5 (2)
Từ (1) và (2) giải hệ phương trình được: x = y = 0,1 mol
Vậy m = mphần 1 + mphần 2= 2.(0,1.56 + 0,1.24) = 16 gam.
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Dãy axit được xếp theo đúng thứ tự axit giảm dần là: HI, HBr, HCl, HF.
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
Chất vừa có tính oxi hóa vừa có tính khử là: SO2.
Vì trong SO2, lưu huỳnh có số oxi hóa là +4, đây là số oxi hóa trung gian của lưu huỳnh.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Gọi kim loại cần tìm là M, hóa trị a
Phương trình phản ứng: 4M + nO2→ 2M2On
Số mol O2là: 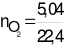 = 0,225 mol
= 0,225 mol

MM=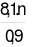 = 9n
= 9n
+ n = 1 suy ra M = 9 (Loại)
+ n = 2 suy ra M = 18 (Loại)
+ n = 3 suy ra M = 27 (Nhận)
Suy ra MM= 27 suy ra m là nhôm (Al).
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong điều kiện thường, dung dịch H2S tiếp xúc với oxi không khí, dung dịch chuyển dần sang màu vàng.
2H2S + O2 (không khí)→ S (↓ vàng) + 2H2O
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số mol MnO2là: 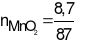 = 0,1 mol
= 0,1 mol
Phương trình phản ứng:

Vậy thể tích khí Cl2(đktc) thu được là:
V = 0,1.22,4 = 2,24 lít.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số mol NaOH là: nNaOH= 1,5.0,2 = 0,3 mol
Phương trình phản ứng: 

Theo phương trình phản ứng: nHCl= 0,3 mol
Vậy thể tích dung dịch HCl 0,6M cần dùng là:
VHCl= 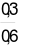 = 0,5 lít
= 0,5 lít
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Trong phòng thí nghiệm, Cl2được điều chế bằng cách cho HCl tác dụng với các chất oxi hóa mạnh như: KMnO4; MnO2...
2KMnO4+ 16HCl → 2KCl + 2MnCl2+ 5Cl2+ 8H2O
MnO2+ 4HCl  MnCl2+ Cl2 + 2H2O
MnCl2+ Cl2 + 2H2O
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Một chất để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím. Chất này là ozon.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Ta có: mdd= D.V = 1,19.100,8 = 119,952 gam
Suy ra mHCl= 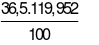 = 43,78 gam ⇒ nHCl= 1,2 mol
= 43,78 gam ⇒ nHCl= 1,2 mol
Số mol H2là 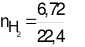 = 0,3 mol
= 0,3 mol
Phương trình phản ứng:


Theo phương trình hóa học có:
nZn = 0,3 mol ⇒ mZn = 19,5 gam
nZnO= 0,3 mol ⇒ mZnO= 24,3 gam
Vậy %mZn=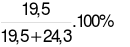 = 44,5%
= 44,5%
%mZnO= 100% - 44,5% = 55,5%
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khi mở một lọ đựng dung dịch axit HCl 37% trong không khí ẩm, thấy có khói trắng bay ra. Khói đó là do nguyên nhânHCl dễ bay hơi, hút ẩm tạo ra các giọt nhỏ axit HCl.
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
SO2+ Br2+ 2H2O → H2SO4+ 2HBr.
Câu 15:
Để phân biệt 5 dung dịch NaCl, NaBr, NaI, NaOH, HCl đựng trong 5 lọ mất nhãn, có thể dùng:
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
- Trích mẫu thử
- Cho quỳ tím vào các mẫu thử:
+ Qùy tím chuyển sang đỏ là HCl
+ Qùy tím chuyển sang xanh là NaOH
+ Không đổi màu là NaCl, NaBr, NaI
- Cho dung dịch AgNO3vào các mẫu thử:
+ Xuất hiện kết tủa trắng (AgCl) là NaCl
NaCl + AgNO3→ AgCl↓ + NaNO3
+ Xuất hiện kết tủa vàng nhạt (AgBr) là NaBr
NaBr + AgNO3→ AgBr↓ + NaNO3
+ Xuất hiện kết tủa vàng đậm (AgI) là NaI
NaI + AgNO3→ AgI↓ + NaNO3
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B.
2KMnO4+ 16HCl  2MnCl2+ 2KCl + 5Cl2+ 8H2O
2MnCl2+ 2KCl + 5Cl2+ 8H2O
Trong phản ứng này, số oxi hóa của Cl(HCl) tăng từ -1 lên 0, vậy HCl thể hiện tính khử.
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Ta có: nHClsau trộn= 3.0,15 + 1.0,35 = 0,8 mol
Vdd= 0,15 + 0,35 = 0,5 lít
Vậy nồng độ mol của dung dịch HCl sau khi trộn là:
CM= 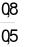 = 1,6M
= 1,6M
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dãy kim loại phản ứng được với dung dịch H2SO4đặc, nguội là Mg, Cu, Ba, Zn.
Mg + 2H2SO4 → MgSO4+ SO2+ 2H2O
Cu + 2H2SO4 → CuSO4+ SO2+ 2H2O
Ba + 2H2SO4 → BaSO4+ SO2+ 2H2O
Zn + 2H2SO4 → ZnSO4+ SO2+ 2H2O
Loại A, B, D do Al, Fe không phản ứng với H2SO4đặc, nguội.
Câu 19:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong hợp chất flo chỉ có số oxi hóa -1.
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dùng AgNO3:
KF + AgNO3→ không phản ứng.
KI + AgNO3→ KNO3+ AgI (↓ vàng)
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
FeS + H2SO4loãng → FeSO4+ H2S↑
FeCO3+ H2SO4loãng → FeSO4+ CO2↑ + H2O
CaSO3+ H2SO4loãng → CaSO4+ SO2↑ + H2O
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hiện tượng khi cho CaCO3tác dụng với dd HCl là: Có khí không màu thoát ra.
CaCO3+ 2HCl → CaCl2+ CO2↑ + H2O
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
2Fe + 6H2SO4→ Fe2(SO4)3+ 3SO2+ 6H2O
Tỉ số giữa số phân tử H2SO4bị khử và số phân tử H2SO4phản ứng trong phương trình phản ứng trên là: 3 : 6 = 1 : 2.
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Ta có: 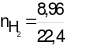 = 0,4 mol ⇒ nHCl= 2.0,4 = 0,8 mol ⇒
= 0,4 mol ⇒ nHCl= 2.0,4 = 0,8 mol ⇒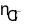 = 0,8 mol
= 0,8 mol
Ta có: mmuối= mKL+ 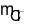 (trong muối) = 20 + 0,8.35,5 = 48,4 gam.
(trong muối) = 20 + 0,8.35,5 = 48,4 gam.
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cho FeS tác dụng với dung dịch HCl, khí bay ra là: H2S.
FeS + 2HCl → FeCl2+ H2S↑
Câu 26:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong phản ứng: Cl2+ 2NaOH → NaCl + NaClO + H2O.
Số oxi hóa của Clo vừa tăng từ 0 lên +1; vừa giảm từ 0 xuống -1 nên Cl2 vừa là chất oxi hóa, vừa là chất khử.
Câu 27:
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Số mol SO2là:  = 0,1 mol
= 0,1 mol
Giả sử phản ứng tạo 1 muối NaHSO3
Bảo toàn nguyên tố S:
 = 0,1 ⇒ mmuối= 10,4 gam = 10,4 gam
= 0,1 ⇒ mmuối= 10,4 gam = 10,4 gam
Chứng tỏ phản ứng tạo muối NaHSO3
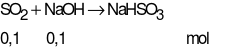
Thể tích NaOH cần dùng là
VNaOH=  = 0,1 lít = 100 ml
= 0,1 lít = 100 ml
Câu 28:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Chất thường được dùng để diệt khuẩn và tẩy màu là: Cl2.
Câu 29:
Tính axit của các chất sau sắp xếp theo chiều giảm dần:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Tính axit của các chất sau sắp xếp theo chiều giảm dần: H2SO4>H2SO3>H2S.
